Kollagen ist ein Protein, das bei Gelenkschmerzen und der Erholung des Weichgewebes helfen kann. Es gibt jedoch viele Nahrungsergänzungsmittel auf dem Markt, und Ihnen sind möglicherweise verschiedene Arten von Kollagen aufgefallen, zum Beispiel Kollagen I, II, II, IV … und so weiter.
Auch wenn die verschiedenen Arten von Kollagen unterschiedliche und essentielle Rollen im Körper spielen, müssen Sie zum Aufbau dieser Kollagene keine separaten Nahrungsergänzungsmittel einnehmen, da sie alle aus den gleichen Aminosäuren bestehen: Glycin, Prolin und Hydroxyprolin. Solange Sie zum richtigen Zeitpunkt (60 – 90 Minuten vor dem Training) ausreichend von diesen Aminosäuren mit einer Vitamin-C-Quelle zu sich nehmen, kann Ihr Körper die verschiedenen Arten von Kollagen aufbauen, die er benötigt.
Es ist jedoch gut zu verstehen, was die verschiedenen Arten von Kollagen im Körper bewirken, warum Sie ausreichend Kollagen zu sich nehmen müssen und wie die verschiedenen Etiketten von Nahrungsergänzungsmitteln zu interpretieren sind.
Inhaltsverzeichnis
Was ist Kollagen?
Kollagen ist ein wichtiger Bestandteil der Gewebestruktur, der ihnen Flexibilität verleiht. In den Muskeln hilft das Bindegewebe dabei, die Kraft der Muskelkontraktionen auf Sehnen und Knochen zu übertragen.
Die Proteine im Bindegewebe verändern sich ständig und können sich anpassen. Der Verzehr von Protein kurbelt die Synthese von Muskelproteinen an.
Für beste Ergebnisse werden in der Regel hochwertige und leicht verdauliche Proteine empfohlen. Interessanterweise zeigen neuere Studien, dass die Proteinaufnahme die Produktion von Proteinen im Muskelbindegewebe nicht erhöht.
Dieser fehlende Anstieg könnte auf unzureichendes Glycin und/oder Prolin zurückzuführen sein. Als Bausteine für die Proteinsynthese des Bindegewebes werden kollagenreiche Lebensmittel mit reichlich Glycin und Prolin empfohlen [1].
Im Körper ist Kollagen wie das Gerüst, das alles zusammenhält. Stellen Sie es sich als den wesentlichen Baustein vor, der die Gesundheit unserer Haut und unseres Bindegewebes erhält [2].
„Bindegewebe“ ist das unterstützende Gerüst, das unsere Organe und Gewebe verbindet. Es besteht aus Fibroblasten und ihrer extrazellulären Matrix, einer Art Gerüst um die Zellen.
Diese extrazelluläre Matrix ist lebenswichtig, da sie dafür sorgt, dass die Zellen zusammenhalten, ihre Stabilität aufrechterhält und den Regenerationsprozess in verschiedenen Geweben unterstützt [3].
Diese Gewebe benötigen Kollagen, um stark, flexibel und in der Lage zu bleiben, sich selbst zu reparieren. Kollagen ist Teil der extrazellulären Matrix, die wie ein Stütznetzwerk für unsere Zellen fungiert [4].
Diese Matrix sorgt für Struktur und hilft bei der Regulierung und Erneuerung unseres Gewebes.
Denken Sie an Sehnen, die harten Bänder, die Muskeln mit Knochen verbinden. Sie sind stark auf Kollagen angewiesen, das einen erheblichen Teil ihres Gewichts ausmacht.
Die einzigartige Struktur von Kollagen, die aus bestimmten Aminosäuren wie Glycin und Prolin besteht, verleiht ihm Festigkeit. Dies ist besonders wichtig, damit die Sehnen den Belastungen und Kräften, wie sie bei sportlichen Aktivitäten auftreten, standhalten, um sie gesund zu halten und das Verletzungsrisiko zu verringern [5].
Kollagen ist also nicht nur ein Protein; Es ist ein entscheidendes Element, das die strukturelle Integrität unseres Körpers unter Kontrolle hält.
Kollagen bildet eine „Dreifachhelix“, die ihm hilft, stark und flexibel zu sein. Die Tripelhelix besteht aus drei Polypeptidketten oder Proteinsträngen, die wie ein Seil ineinander verschlungen sind.
Diese Ketten sind reich an Aminosäuren, wobei Glycin am häufigsten vorkommt. Auch Prolin und Hydroxyprolin sind entscheidend für die Stabilisierung der Struktur [2, 6].
Durch diese Kombination aus Festigkeit und Flexibilität eignet sich Kollagen gut zur strukturellen Unterstützung von Geweben wie Haut, Sehnen und Knochen.
Sollten Sie einen bestimmten Kollagentyp einnehmen?

Kollagen Typ I ist in Knochen, Muskeln und Bindegewebe vorherrschend. Es gibt noch nicht genügend Forschungsergebnisse, um sagen zu können, dass der Verzehr von Kollagen Typ I dem Verzehr anderer Kollagentypen wie Typ II oder III überlegen ist, da sie alle ähnliche Bausteine – d. h. Aminosäuren – enthalten.
Interessanterweise verwenden viele Studien auch Gelatine als Kollagenquelle, wenn sie die Wirkung von Kollagen auf den Körper untersuchen.
Ich möchte noch einmal betonen, dass die Hauptpriorität darin besteht, die verschiedenen Aminosäuren aufzunehmen, die die verschiedenen Kollagentypen aufbauen können.
Da Kollagen Typ I jedoch eine so wichtige Rolle in Knochen, Muskeln und Bindegewebe spielt, ist es durchaus sinnvoll, sich bei der Auswahl eines Kollagenpräparats dafür zu entscheiden.
Verschiedene Arten von Kollagen
Es gibt insgesamt 29 Exemplare, die jeweils in der Reihenfolge ihrer Entdeckung mit den römischen Ziffern I-XXIX gekennzeichnet sind [7, 8]. Jeder Kollagentyp hat einzigartige Eigenschaften, Funktionen und Standorte im Körper [2].
Verschiedene Kollagentypen weisen strukturelle Unterschiede auf, die dazu beitragen, dass sie an verschiedenen Stellen unterschiedliche Körperfunktionen ausüben.
Die Zusammensetzung und Anordnung der Aminosäuren bestimmt die physikalische Struktur von Kollagen und wie einzelne Kollagenmoleküle interagieren, um größere Strukturen zu bilden [2, 5, 9].
Hier erfahren Sie, wie die physikalische Struktur mit der Vielfalt der Kollagentypen zusammenhängt:
- Aminosäurezusammensetzung:
Die Aminosäurezusammensetzung von Kollagen variiert je nach Typ. Beispielsweise haben die Kollagentypen I und II einen hohen Glycin-, Prolin- und Hydroxyprolingehalt, während andere Typen möglicherweise andere Aminosäurezusammensetzungen aufweisen. Diese Variation beeinflusst die Stärke, Flexibilität und Stabilität der Kollagenstruktur [9].
- Triple-Helix-Struktur:
Die „Dreifachhelix“ bezieht sich auf die Art und Weise, wie Kollagen zusammengesetzt wird. Jede Struktur besteht aus drei Polypeptidketten, die fast wie ein Seil umeinander gedreht sind.
Jede dieser Ketten ist als bekannt Alpha Kette (denken Sie daran, da wir später in diesem Beitrag darauf verweisen). Der spezifische Kollagentyp wird durch die Anordnung dieser Alphaketten und die Eigenschaften der resultierenden Kollagenstruktur bestimmt.
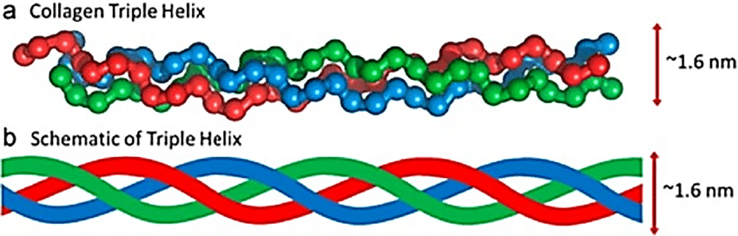
Abbildung 1: Die Kollagen-Triple-Helix-Struktur [10]
- Fibrillenbildung:
Kollagenmoleküle fügen sich zu größeren Strukturen wie Fibrillen und Fasern zusammen [2, 9].
„Fibrillen“ beziehen sich auf winzige, fadenförmige Strukturen, die kleiner als Fasern, aber größer als einzelne Moleküle sind. Stellen Sie sie sich als Miniaturfäden oder -stränge vor, die eine größere Struktur bilden. Im Zusammenhang mit Kollagen sind Fibrillen die Bausteine der Kollagenfasern.
Stellen Sie sich ein Seil vor, das aus vielen kleinen, miteinander verdrehten Fäden besteht. Jeder dieser Fäden kann mit einer Fibrille verglichen werden.
Diese Fibrillen vereinen ihre Kräfte, um eine bedeutendere und stärkere Struktur zu schaffen, ähnlich wie sich die Fäden in einem Seil zu einer robusten und haltbaren Schnur verbinden.
Die Art und Weise, wie sich diese Strukturen bilden, und die Wechselwirkungen zwischen Kollagenmolekülen beeinflussen die physikalischen Eigenschaften von Geweben.
- Vernetzung:
Kollagenfasern werden durch vernetzende chemische Bindungen zwischen benachbarten Kollagenmolekülen stabilisiert. Das Muster und das Ausmaß der Vernetzung tragen zur Stärke und Widerstandsfähigkeit kollagenreicher Gewebe bei, wie in Abbildung 2 dargestellt.
Verschiedene Kollagentypen können unterschiedliche Vernetzungsmuster aufweisen, die sich auf die physikalischen Eigenschaften von Geweben auswirken [11].
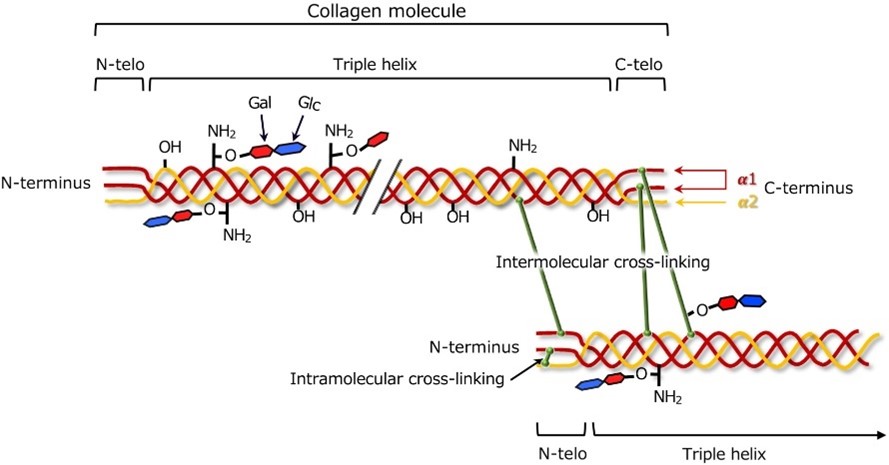
Abbildung 2: Kollagenvernetzung [12]
Basierend auf der Art und Weise, wie sie im Gewebe aufgebaut sind, unterscheiden sich Kollagene genetisch und werden in Untergruppen eingeteilt [13].
Kollagene wie I, II, III, V und X bilden zusammen große Fibrillen außerhalb der Zellen, weshalb sie als fibrillenbildende Kollagene bezeichnet werden.
Kollagen Typ IV hingegen bildet ein kreuz und quer verlaufendes Netzwerk in Basalmembranen. Dann gibt es Kollagen Typ VI, das einzigartige Mikrofibrillen bildet, und Kollagen Typ VII, das Verankerungsfibrillen bildet.
Eine Gruppe namens FACIT-Kollagene [14] (fibrillenassoziierte Kollagene mit unterbrochenen Dreifachhelices), einschließlich der Typen IX, XII, XIV, XIX, XX und XXI, verbünden sich mit den größeren Kollagenfasern und wirken wie molekulare Brücken.
Ihre Aufgabe ist es, die extrazelluläre Matrix organisiert und stabil zu halten. Es ist, als wären sie das Support-Team, das dafür sorgt, dass alles an seinem Platz bleibt.
Typ I

Kollagen Typ I ist ein wichtiger Baustein, der in unseren Knochen, unserer Haut und unserem Bindegewebe vorkommt [15]. Es ist nicht nur die am häufigsten vorkommende Art von Kollagen, sondern spielt auch eine wichtige Rolle bei der Aufrechterhaltung der Struktur und Stärke dieser Gewebe.
Betrachten Sie es als den Hauptarchitekten, der das Grundgerüst für verschiedene Teile unseres Körpers bildet. Wissenschaftler haben Kollagen Typ I aufgrund seiner Bedeutung eingehend untersucht und sind damit der am besten untersuchte Kollagentyp.
Es ist ein grundlegender Bestandteil fast jedes Bindegewebes und bildet die Primärstruktur der interstitiellen Membran, die unseren Körper stützt und zusammenhält.
Über seine strukturelle Bedeutung hinaus Kollagen Typ I findet in verschiedenen medizinischen Bereichen Anwendung, darunter chirurgische Eingriffe, Wundheilung und Gewebezüchtung [16], was seine Vielseitigkeit und Bedeutung für die Förderung von Gesundheit und Genesung unterstreicht.
Typ II
Lassen Sie es mich für Sie aufschlüsseln: Kollagen Typ II ist der Hauptbestandteil der Knorpelstruktur, das ist das Material, das Ihre Gelenke dämpft und stützt.
Etwa 90 % des Kollagens im Knorpel ist Kollagen Typ II [17].
Die einzigartigen Eigenschaften von Kollagen Typ II machen es für die Widerstandsfähigkeit und stoßdämpfenden Eigenschaften des Knorpels unerlässlich, was für die Gesundheit der Gelenke von entscheidender Bedeutung ist.
Kollagen Typ 2 bildet ein Netzwerk aus winzigen Fasern, die für die Festigkeit des Knorpels erforderlich sind [18, 19].
Kollagen Typ II spielt auch eine wichtige Rolle beim Wachstum und den Veränderungen von Zellen (Chondrozyten genannt) bei der normalen Knorpelentwicklung und bei Osteoarthritis (OA), einer Erkrankung, die die Gelenke betrifft.
Wenn Kollagen Typ II verloren geht, kann es das Wachstum von Chondrozyten und das Fortschreiten der Arthrose beschleunigen.
Dies geschieht über den sogenannten BMP-SMAD1-Weg, der wie ein Kommunikationssystem innerhalb der Zellen ist.
Kurz gesagt ist eine ausreichende Versorgung mit Kollagen Typ II unerlässlich, um Ihren Knorpel gesund zu halten und einer Verschlimmerung der Arthrose vorzubeugen [20].
Eine im Jahr 2016 durchgeführte Studie hat gezeigt, dass die gemeinsame Anwendung von nativem Kollagen Typ II und Paracetamol (eine Art Medikament zur Behandlung von Arthrose) die Symptome bei Menschen mit Knie-Arthrose besser lindert als die alleinige Verwendung von Paracetamol.
Daher scheint die Kombination dieser beiden Behandlungen wirksamer zu sein, um Patienten bei der Bewältigung ihrer Knie-Arthrose-Symptome zu helfen [21].
Typ III

Kollagen Typ III wurde 1971 entdeckt und ist ein wichtiger Akteur in der Kollagenfamilie. Es macht etwa 5–20 % des gesamten Kollagengehalts in unserem Körper aus. Es ist wie ein grundlegender Baustein, der zur strukturellen Integrität beiträgt [22].
Kollagen vom Typ III wird auch als Kollagen-Alpha-1(III)-Kette oder Alpha-1-Kette von Typ-III-Kollagen bezeichnet [23] (Denken Sie daran, dass wir erwähnt haben, dass die Alphaketten die einzelnen „Seile“ sind, aus denen die Kollagen-Triple-Helix-Struktur besteht.)
Kollagen Typ III ist ein Protein, das beim Menschen vom COL3A1-Gen kodiert wird (das bedeutet, dass das Gen den Körper anweist, Kollagen Typ III herzustellen). [23].
Es kommt in erheblichen Mengen in großen Blutgefäßen, der Gebärmutter und dem Darm vor und dient als Strukturbestandteil, also im Wesentlichen als Gerüst für diese Hohlorgane.
Aber seine Bedeutung geht über die Struktur hinaus. Es interagiert mit den Blutplättchen in unserem Blut, unterstützt den Gerinnungsprozess und fungiert außerdem als Signalmolekül bei der Wundheilung.
Die Bedeutung von Kollagen Typ III wird noch deutlicher, wenn man Personen mit Mutationen im COL3A1-Gen untersucht.
Diese Mutationen können zu schwerwiegenden Problemen wie spontanen Rissen in Arterien, der Gebärmutter und dem Darm (Ihrem Darm) führen.
Dies unterstreicht die unverzichtbare Rolle von Kollagen Typ III für die strukturelle Intaktheit dieser Organe [24, 25, 26].
Interessanterweise können Mutationen im COL3A1-Gen auch zu schweren Hirnanomalien führen. Dies deutet darauf hin, dass es bei Kollagen Typ III nicht nur um die physikalische Struktur geht.
Es ist auch für die normale Gehirnentwicklung von größter Bedeutung [27, 28, 29].
Kollagen Typ III ist also nicht nur ein strukturelles Kraftwerk, sondern spielt auch eine wichtige Rolle in unserem gesamten Körper und beeinflusst sowohl die physische Struktur als auch die funktionellen Prozesse.
Typ IV
Kollagen Typ IV ist ein Protein, das über mehrere Gewebe verteilt ist, insbesondere in einem Bereich, der Basalmembran genannt wird.
Es kann an verschiedenen Stellen im Körper gefunden werden, beispielsweise in Haaren, Zelloberflächen und der Plazenta [30].
Was Kollagen Typ IV interessant macht, ist seine Struktur. Am Ende seiner Kette (C-Terminus) befindet sich die sogenannte C4-Domäne, die im Gegensatz zu anderen Kollagenen während des Proteinherstellungsprozesses nicht entfernt wird.
Diese einzigartige Eigenschaft führt dazu, dass die Kollagenfasern Kopf an Kopf und nicht nebeneinander miteinander verbunden werden [30].
Kollagen Typ IV weist nicht an jeder dritten Position seiner Kette eine bestimmte Aminosäure (Glycin) auf, was für andere Kollagentypen typisch ist.
Dieses Fehlen macht Kollagen vom Typ IV flexibler und in seiner Gesamtform gebogener als andere Kollagenarten [31].
Aufgrund dieser Strukturmerkmale verfügt Kollagen Typ IV über eine besondere Fähigkeit – es kann Schichten bilden. Diese Schichten sind ein wesentlicher Teil der Struktur der Basalmembran der Haut.
Das bedeutet, dass Kollagen vom Typ IV eine ausgeprägte Struktur hat, die es ihm ermöglicht, flexible, gebogene Schichten zu bilden, und dass es eine Schlüsselrolle bei der Struktur der Basalmembran der Haut spielt [32, 33].
Typ V
Kollagen Typ V ist wie ein „Manager“-Kollagen, das dabei hilft, die Bildung von Fibrillen (die wie Kollagenfäden sind) zu regulieren.
Es gibt mindestens drei verschiedene Versionen – α1(V)2 α2(V), α1(V)3 und α1(V)α2(V)α3(V). Diese Versionen werden durch die Kombination von drei verschiedenen Alphaketten hergestellt – α1(V), α2(V) und α3(V). [34].
Kollagen Typ V ist nicht die Hauptfigur in der Geschichte der extrazellulären Matrix; Es ist eher wie ein Nebendarsteller. Es verbindet sich mit anderen Kollagenen wie Kollagen Typ I und bildet diese gemischten Fibrillen oder dünnen Fäden mit unterschiedlichen Eigenschaften [35].
Zellen in verschiedenen Teilen unseres Körpers produzieren Kollagen vom Typ V und seine Produktion wird durch Dinge wie TGF-β (Transforming Growth Factor Beta) und andere Wachstumsfaktoren beeinflusst [36].
Auch wenn es der Verdauung durch bestimmte Enzyme standhält [37], es ist nicht unbesiegbar – Metalloproteinasen und Gelatinasen (bestimmte Enzyme im Körper) können es abbauen und so beim Umbau (Aufbau) der extrazellulären Matrix helfen [38].
Kollagen Typ V ist wie ein Teamplayer. Es interagiert mit anderen Kollagentypen und Strukturproteinen und stärkt so das Gerüst in unserem Gewebe.
Es interagiert auch mit Matrixmakromolekülen und beeinflusst so das Verhalten und die Funktion der Zellen in unserem Körper [37]. Kollagen Typ V spielt eine entscheidende Rolle bei der Aufrechterhaltung der Struktur und Funktion unseres Gewebes.
Typ VI
Kollagen VI spielt in den Geweben, in denen es vorkommt, verschiedene Rollen: Es erfüllt mechanische Funktionen, schützt Zellen durch Hemmung der Apoptose (programmierter Zelltod) und schützt vor oxidativen Schäden.
Es trägt auch zur Tumorentwicklung und -progression bei, indem es die Zelldifferenzierung und autophagische Mechanismen beeinflusst [39].
Dieser Kollagentyp spielt eine Rolle bei der Verankerung von Zellen und Geweben und trägt so zur Gesamtstabilität der extrazellulären Matrix bei.
Typ VII
Kollagen Typ VII erhielt seinen Namen, weil die Menschen zunächst dachten, es handele sich um ein besonders langes Molekül, weshalb sie es „langkettiges Kollagen“ nannten.
Dieses Kollagen ist wichtig für die Bildung von Verankerungsfibrillen. Diese sind wie Stützbalken, die dafür sorgen, dass die äußere Hautschicht (Epidermis) an einer bestimmten Schnittstelle namens Lamina lucida/papilläre Dermis an der tieferen Schicht (Dermis) haftet [40].
Typ VIII
Kollagen Typ VIII wird von verschiedenen Zelltypen produziert, darunter Endothelzellen (die Blutgefäße auskleiden), Keratinozyten (Zellen in der äußeren Hautschicht), Mastzellen (eine Art Immunzelle) und mikrovaskuläre Endothelzellen (winzige Blutgefäße). und sogar einige Tumorzellen.
Man findet es in verschiedenen extrazellulären Matrizen, wie im weißen Teil Ihres Auges (Sklera), der Haut und den winzigen Filtern in Ihren Nieren (Glomerulus) [6, 41].
Was seine Struktur betrifft, besteht Kollagen vom Typ VIII aus zwei Alpha-Ketten, nämlich [Alpha 1(VIII)2 Alpha 2(VIII)] [42].
Seine Rolle im Körper ist noch unbekannt, obwohl neuere Studien darauf hinweisen, dass es in Blutgefäßen relativ wichtig ist.
Einige Untersuchungen deuten darauf hin, dass es möglicherweise eine Rolle bei der Bewegung glatter Muskelzellen spielt, die für die Aufrechterhaltung der Struktur der Blutgefäße von entscheidender Bedeutung ist.
Forscher spekulieren, dass Kollagen vom Typ VIII als eine Art Grundlage für verschiedene Zellen fungieren könnte, indem es Endothelzellen dabei hilft, sich bei der Bildung neuer Blutgefäße zu bewegen (Angiogenese), und glatten Muskelzellen dabei hilft, in die innere Schicht von Blutgefäßen einzudringen (intimale Invasion). Unterstützung von Myofibroblasten bei Gewebevernarbungen (fibrotische Zustände) [43].
Geben Sie X ein
Kollagen Typ X ist ein besonderes Mitglied der kurzkettigen Kollagenfamilie, das hauptsächlich im Knorpel vorkommt und für das Knochenwachstum und die Knochenentwicklung entscheidend ist.
Es kommt hauptsächlich in den Wachstumsfugen der Knochen vor, wo während der Entwicklung und des Wachstums neue Knochen entstehen.
Die Hauptfunktion von Kollagen Typ X besteht darin, zur Knochenentwicklung und -mineralisierung beizutragen, insbesondere in den Wachstumsfugen.
Es ist wie ein Marker für einen bestimmten Typ reifer Knorpelzellen, die „hypertrophen Chondrozyten“ genannt werden. [44]. Beim Menschen können bis zu 18 % der Kollagensynthese in bestimmten Regionen vom Typ X sein.
Es wird angenommen, dass seine Rolle den Verkalkungsprozess unterstützt und möglicherweise die Organisation der Knorpelmatrix beeinflusst.
Forscher glauben, dass Kollagen Typ X für das Verständnis des Wachstums und der Differenzierung von Chondrozyten von entscheidender Bedeutung ist. Mutationen in diesem Kollagentyp könnten mit bestimmten Störungen der Knochenentwicklung verbunden sein [45].
Insgesamt bietet Kollagen Typ X eine Perspektive in der Knorpelbiologie und hilft Forschern, mehr über Knochenwachstum und -entwicklung zu erfahren.
Typ XI
Kollagen Typ XI spielt eine Rolle im strukturellen Gerüst des Körpers.
Als fibrilläres Kollagen ist es in verschiedenen Geweben wie Gelenkknorpel, Hoden, Sehnen, Knochen, Muskeln, Plazenta, Lunge und sogar im Neoepithel des Gehirns weit verbreitet.
Seine Aufgabe ist es, die Fibrillogenese zu regulieren, die zur Bildung von Kollagenfibrillen beiträgt – jenen fadenförmigen Strukturen, die unser Gewebe zusammenhalten [46].
Eine seiner Funktionen besteht darin, den Abstand und Durchmesser der Typ-II-Kollagenfibrillen aufrechtzuerhalten und als Überwacher für deren ordnungsgemäße Bildung zu fungieren. Es spielt auch eine Rolle bei der Ankurbelung der Bildung von Kollagen Typ I und II [46].
Es kann Substanzen wie Heparin, Heparansulfat und Dermatansulfat binden. Trotz seiner potenziellen Bedeutung fehlen uns jedoch derzeit spezifische Biomarker zur Messung von Kollagen Typ XI [47].
Typen XII, XIV und XVI
Kollagen vom Typ
Es handelt sich um ein „homotrimeres“ Molekül, das heißt, es besteht aus drei identischen Teilen. Stellen Sie es sich als eine große kreuzförmige Struktur mit spezifischen Domänen vor, die den Raum um die Kollagenfibrillen erreichen.
Dieses Kollagen hat zwei Formen: eine kleinere, die in der Haut und dergleichen vorkommt, und eine größere, die in Epidermiszellen vorkommt [48].
Lassen Sie uns nun über Kollagen Typ XIV sprechen. Es ist ähnlich, aber mit einer kleineren kreuzförmigen Struktur. Kollagen vom Typ XIV verteilt sich gleichmäßiger in verschiedenen Geweben und interagiert mit Kollagen vom Typ I an Stellen wie Haut, Sehnen und mehr. Es bindet nicht direkt an Kollagen Typ I, sondern an eine Substanz namens Decorin [48].
Schließlich haben wir Kollagen vom Typ XVI, das von Fibroblasten und Myoblasten synthetisiert wird. Es ist Teil der Show in der territorialen Matrix der Chondrozyten, dieser Zellen im Knorpel.
Stellen Sie es sich als diesen integrierten Player in dünnen Kollagenfibrillen vor, der mit Kollagen Typ II und XI zusammenhängt.
Es ist wie ein Team hinter den Kulissen in verschiedenen Teilen unseres Körpers, das dafür sorgt, dass die Dinge genau richtig strukturiert sind [48].
Benötigen Sie alle Arten von Kollagen?

Um Kollagen im Körper aufzubauen, benötigen Sie die Grundbausteine von Kollagen – Zu den Aminosäuren gehören Glycin, Prolin, Lysin, Hydroxylysin und Hydroxyprolin [49].
Darüber hinaus benötigen Sie Vitamin C, um die Bildung von Kollagen im Körper zu unterstützen. Vitamin C ist wichtig für das Bindegewebe, da es die Arbeit eines Enzyms namens Prolyl-4-hydroxylase ermöglicht.
Dieses Enzym wird benötigt, um Prolin, einen Baustein von Proteinen, umzuwandeln, und hilft bei der Herstellung und Freisetzung von Prokollagen.
Sie müssen nicht alle Arten von Kollagen zu sich nehmen, solange Sie genügend Bausteine – also Aminosäuren – zu sich nehmen, aus denen Kollagen besteht.
Kollagenpräparate und sogar Gelatine werden alle in Glycin, Prolin, Lysin, Hydroxylysin und Hydroxyprolin zerlegt und können zum Aufbau der verschiedenen Arten von Kollagen im Körper verwendet werden.
Spielt die Kollagenquelle eine Rolle?
Tierisches Kollagenprotein ist möglicherweise nicht für vegetarische oder vegane Sportler geeignet.
Während es vegane und vegetarische Produkte gibt, die tierisches Kollagen nachbilden sollen, wenn Peptide, die nur in tierischen Proteinen vorkommen, nachweislich eine ausgeprägte biologische Aktivität besitzen, könnten vegetarische und vegane Alternativen als weniger effizient angesehen werden.
Weitere Untersuchungen sind erforderlich, um die Aminosäureverfügbarkeit und Wirksamkeit veganer Kollagenersatzstoffe zu beurteilen.
Verschiedene tierische Kollagenquellen weisen geringfügige Unterschiede in ihrem Aminosäuregehalt auf, die Unterschiede sind jedoch nicht signifikant genug, um eine Art gegenüber einer anderen als überlegen zu bezeichnen.
Tabelle 1: Aminosäurezusammensetzung der 5 wichtigsten Kollagene und Gelatine von Säugetieren [50]
| Aminosäure | Tierische Gelatine | |||||||
| Ochsenhaut | Kommerzieller Knochen | Schweinehaut | Ochsenknochen | Haifischhaut | Lungenfischhaut | Knochen | Sehne | |
| Glycine | 27.5 | 27.2 | 26.4 | 25.3 | 26.5 | 24 | 25.8 | 25.4 |
| Leucine | 3.3 | 3.5 | 3.3 | 3.9 | 3.5 | 2.8 | 3.6 | 3.6 |
| Proline | 16.4 | 15.5 | 16.2 | 14.7 | 13.9 | 15.8 | 15.3 | 15.2 |
| Hydroxyproline | 14.1 | 13.3 | 13.5 | 14.1 | 10.9 | 10.8 | 14.1 | 12.6 |
| Hydroxylysin | 1.0 | 0.7 | 1.0 | 1.1 | 0.8 | 1.1 | 0.6 | |
Beste Art von Kollagen
Die Debatte über die Überlegenheit der Kollagentypen bleibt aufgrund ihrer ähnlichen Aminosäureprofile ungeklärt. Kollagen Typ I erweist sich aufgrund seiner entscheidenden Rolle bei der Stärkung von Knochen, Muskeln und Bindegewebe als strategische Wahl.
Der Fokus sollte auf einer breiten Aminosäurezufuhr zur allgemeinen Kollagenunterstützung liegen. Wenn Sie jedoch gezielte Vorteile erzielen möchten, ist die Verwendung von Kollagen Typ I möglicherweise die beste Wahl.
Bibliographie
- Abreu-Velez, AM, & Howard, MS (2012). Kollagen IV in normaler Haut und bei pathologischen Prozessen. N Am J Med Sci, 4(1), 1-8. doi:10.4103/1947-2714.92892
- Adam, MP, Feldman, J., Mirzaa, GM, Pagon, RA, Wallace, SE, Bean, LJ, . . . Amemiya, A. (1993). GeneReviews®[Internet].
- Alcaide-Ruggiero, L., Molina-Hernández, V., Granados, MM, & Domínguez, JM (2021). Haupt- und Nebentypen von Kollagenen im Gelenkknorpel: Die Rolle von Kollagenen bei der Bewertung des Reparaturgewebes bei Knorpeldefekten. Int J Mol Sci, 22(24). doi:10.3390/ijms222413329
- Aycock, RS, & Seyer, JM (1989). Kollagene der normalen und zirrhotischen menschlichen Leber. Bindegewebsforschung, 23(1), 19-31.
- Baar, K. (2017). Verletzungen minimieren und Rückkehr zum Spiel maximieren: Lehren aus konstruierten Bändern. Sportmed, 47(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
- Bakilan, F., Armagan, O., Ozgen, M., Tascioglu, F., Bolluk, O. & Alatas, O. (2016). Auswirkungen der Behandlung mit nativem Kollagen Typ II auf Knie-Arthrose: Eine randomisierte kontrollierte Studie. Eurasian J Med, 48(2), 95-101. doi:10.5152/eurasianjmed.2015.15030
- Birk, DE (2001). Typ-V-Kollagen: Heterotypische Typ-I/V-Kollagen-Wechselwirkungen bei der Regulierung der Fibrillenanordnung. Mikron, 32(3), 223-237.
- Byers, PH, Belmont, J., Black, J., De Backer, J., Frank, M., Jeunemaitre, X., . . . Sanders, L. (2017). Diagnose, Naturgeschichte und Behandlung beim vaskulären Ehlers-Danlos-Syndrom. Vortrag gehalten im American Journal of Medical Genetics Teil C: Seminare in medizinischer Genetik.
- Cao, Q., Mak, KM, & Lieber, CS (2002). DLPC verringert die TGF-β1-induzierte Kollagen-mRNA durch Hemmung von p38 MAPK in hepatischen Sternzellen. American Journal of Physiology-Gastrointestinal and Liver Physiology, 283(5), G1051-G1061.
- Chung, HJ, & Uitto, J. (2010). Kollagen Typ VII: das verankernde Fibrillenprotein, das bei der dystrophischen Epidermolysis bullosa verantwortlich ist. Dermatol Klinik, 28(1), 93-105. doi:10.1016/j.det.2009.10.011
- Clifford, T., Ventress, M., Allerton, DM, Stansfield, S., Tang, JCY, Fraser, WD, . . . Stevenson, E. (2019). Die Auswirkungen von Kollagenpeptiden auf Muskelschäden, Entzündungen und Knochenumsatz nach körperlicher Betätigung: eine randomisierte, kontrollierte Studie. Aminosäuren, 51(4), 691-704. doi:10.1007/s00726-019-02706-5
- Di Martino, A., Cescon, M., D'Agostino, C., Schilardi, F., Sabatelli, P., Merlini, L. & Faldini, C. (2023). Kollagen VI im Bewegungsapparat. Int J Mol Sci, 24(6). doi:10.3390/ijms24065095
- Dong, C. & Lv, Y. (2016). Anwendung von Kollagengerüsten im Tissue Engineering: Aktuelle Fortschritte und neue Perspektiven. Polymere (Basel), 8(2). doi:10.3390/polym8020042
- Ellingson, AJ, Pancheri, NM, & Schiele, NR (2022). Regulatoren der Kollagenvernetzung in sich entwickelnden und erwachsenen Sehnen. Eur Cell Mater, 43, 130-152. doi:10.22203/eCM.v043a11
- Frantz, C., Stewart, KM, & Weaver, VM (2010). Die extrazelluläre Matrix auf einen Blick. J Cell Sci, 123(Teil 24), 4195-4200. doi:10.1242/jcs.023820
- Hasegawa, H., Naito, I., Nakano, K., Momota, R., Nishida, K., Taguchi, T., . . . Ohtsuka, A. (2007). Die Verteilungen von Typ-IV-Kollagen-α-Ketten in Basalmembranen der menschlichen Epidermis und Hautanhangsgebilde. Archiv für Histologie und Zytologie, 70(4), 255-265.
- Holwerda, AM, & van Loon, LJC (2022). Der Einfluss der Einnahme von Kollagenprotein auf den Umbau des muskuloskelettalen Bindegewebes: eine narrative Übersicht. Nutr Rev, 80(6), 1497-1514. doi:10.1093/nutrit/nuab083
- Horn, D., Siebert, E., Seidel, U., Rost, I., Mayer, K., Abou Jamra, R., . . . Kornak, U. (2017). Biallelische COL3A1-Mutationen führen zu einem klinischen Spektrum spezifischer struktureller Hirnanomalien und Bindegewebsanomalien. American Journal of Medical Genetics Teil A, 173(9), 2534-2538.
- Jørgensen, A., Fagerheim, T., Rand-Hendriksen, S., Lunde, PI, Vorren, TO, Pepin, MG, . . . Byers, PH (2015). Vaskuläres Ehlers-Danlos-Syndrom bei Geschwistern mit biallelischen COL3A1-Sequenzvarianten und deutlicher klinischer Variabilität in der Großfamilie. Europäisches Journal für Humangenetik, 23(6), 796-802.
- Kannus, P. (2000). Aufbau des Sehnenbindegewebes. Scand J Med Sci Sports, 10(6), 312-320. doi:10.1034/j.1600-0838.2000.010006312.x
- Kapandji, I. (1977). Die Physiologie der Gelenke. Churchill Livingstone, 2, 186-189.
- Khoshnoodi, J., Pedchenko, V. & Hudson, BG (2008). Säugetierkollagen IV. Microsc Res Tech, 71(5), 357-370. doi:10.1002/jemt.20564
- Konomi, H., Hayashi, T., Nakayasu, K. & Arima, M. (1984). Lokalisierung von Kollagen Typ V und Kollagen Typ IV in menschlicher Hornhaut, Lunge und Haut. Immunhistochemischer Nachweis durch Anti-Kollagen-Antikörper, charakterisiert durch Immunelektroblotting. Das American Journal of Pathology, 116(3), 417.
- Kuivaniemi, H. & Tromp, G. (2019). Kollagen Typ III (COL3A1): Gen- und Proteinstruktur, Gewebeverteilung und damit verbundene Krankheiten. Gene, 707, 151-171. doi:10.1016/j.gene.2019.05.003
- Lian, C., Wang, X., Qiu, X., Wu, Z., Gao, B., Liu, L., . . . Peng, Y. (2019). Kollagen Typ II unterdrückt die artikuläre Chondrozytenhypertrophie und das Fortschreiten der Arthrose, indem es die Integrin-β1-SMAD1-Interaktion fördert. Knochenforschung, 7(1), 8.
- Luo, YY, & Karsdal, MA (2016). Kapitel 11 – Kollagen Typ XI. In MA Karsdal (Hrsg.), Biochemie von Kollagenen, Lamininen und Elastin (S. 77-80): Academic Press.
- Mak, KM, Png, CY und Lee, DJ (2016). Kollagen Typ V in Gesundheit, Krankheit und Fibrose. Anat Rec (Hoboken), 299(5), 613-629. doi:10.1002/ar.23330
- Malfait, F., Francomano, C., Byers, P., Belmont, J., Berglund, B., Black, J., . . . Burrows, NP (2017). Die internationale Klassifikation der Ehlers-Danlos-Syndrome 2017. Vortrag gehalten im American Journal of Medical Genetics Teil C: Seminare in medizinischer Genetik.
- Miller, EJ, Epstein Jr, EH und Piez, KA (1971). Identifizierung von drei genetisch unterschiedlichen Kollagenen durch Spaltung von unlöslichem menschlichem Haut- und Knorpelkollagen mit Bromcyan. Biochemische und biophysikalische Forschungskommunikation, 42(6), 1024-1029.
- Moriya, K., Bae, E., Honda, K., Sakai, K., Sakaguchi, T., Tsujimoto, I., . . . Sakai, T. (2011). Ein Fibronektin-unabhängiger Mechanismus der Kollagenfibrillogenese beim Leberumbau bei Erwachsenen. Gastroenterologie, 140(5), 1653-1663.
- Muragaki, Y., Jacenko, O., Apte, S., Mattei, M., Ninomiya, Y. & Olsen, BR (1991). Das Kollagen-Gen Alpha 2 (VIII). Ein neues Mitglied der Familie der kurzkettigen Kollagene, das sich auf dem menschlichen Chromosom 1 befindet. Zeitschrift für Biologische Chemie, 266(12), 7721-7727.
- Myllyharju, J. & Kivirikko, KI (2004). Kollagene, modifizierende Enzyme und ihre Mutationen bei Menschen, Fliegen und Würmern. TRENDS in der Genetik, 20(1), 33-43.
- Nah, HD, Swoboda, B., Birk, DE, & Kirsch, T. (2001). Prokollagen vom Typ IIA: Expression im sich entwickelnden Gliedmaßenknorpel von Hühnern und im menschlichen osteoarthritischen Gelenkknorpel. Entwicklungsdynamik: Eine offizielle Veröffentlichung der American Association of Anatomists, 220(4), 307-322.
- Naomi, R., Ridzuan, PM, & Bahari, H. (2021). Aktuelle Erkenntnisse zu Kollagen Typ I. Polymere (Basel), 13(16). doi:10.3390/polym13162642
- Olsen, BR (1995). Neue Erkenntnisse zur Funktion von Kollagenen aus genetischer Analyse. Aktuelle Meinung in der Zellbiologie, 7(5), 720-727.
- Patel, K., Munir, D. & Santos, R. (2022). Nützliche Verwendung von Tierhäuten für die Abfallentsorgung in Schlachthöfen und Gerbereien: ein Überblick über unkonventionelle, innovative und nachhaltige Ansätze. Umweltwissenschaften und Umweltverschmutzungsforschung, 29. doi:10.1007/s11356-021-17101-5
- Plancke, A., Holder-Espinasse, M., Rigau, V., Manouvrier, S., Claustres, M. & Van Kien, PK (2009). Homozygotie für ein Null-Allel von COL3A1 führt zum rezessiven Ehlers-Danlos-Syndrom. Europäisches Journal für Humangenetik, 17(11), 1411-1416.
- Plenz, GA, Deng, MC, Robenek, H. & Völker, W. (2003). Gefäßkollagene: Schwerpunkt auf der Rolle von Typ-VIII-Kollagen bei der Atherogenese. Arteriosklerose, 166(1), 1-11.
- Ricard-Blum, S. (2011). Die Kollagenfamilie. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
- Schmid, TM, & Linsenmayer, TF (1990). Immunelektronenmikroskopie von Typ-X-Kollagen: supramolekulare Formen im embryonalen Hühnerknorpel. Dev Biol, 138(1), 53-62. doi:10.1016/0012-1606(90)90176-j
- Shen, G. (2005). Die Rolle von Kollagen Typ X bei der Erleichterung und Regulierung der endochondralen Ossifikation des Gelenkknorpels. Orthod Craniofac Res, 8(1), 11-17. doi:10.1111/j.1601-6343.2004.00308.x
- Shuttleworth, CA (1997). Kollagen Typ VIII. Int J Biochem Cell Biol, 29(10), 1145-1148. doi:10.1016/s1357-2725(97)00033-2
- Smith, SM, & Melrose, J. (2019). Kollagen-Perlecan-HS-Wechselwirkungen vom Typ XI stabilisieren die perizelluläre Matrix von Anulus-Fibrosus-Zellen und Chondrozyten und sorgen für Matrixstabilisierung und Homöostase. Zeitschrift für Molekulare Histologie, 50(3), 285-294. doi:10.1007/s10735-019-09823-1
- Söderhäll, C., Marenholz, I., Kerscher, T., Rüschendorf, F., Esparza-Gordillo, J., Worm, M., . . . Rohde, K. (2007). Varianten in einem neuartigen epidermalen Kollagen-Gen (COL29A1) werden mit atopischer Dermatitis in Verbindung gebracht. PLoS-Biologie, 5(9), e242.
- Sorushanova, A., Delgado, LM, Wu, Z., Shologu, N., Kshirsagar, A., Raghunath, R., . . . Zeugolis, DI (2019). Die Kollagen-Suprafamilie: Von der Biosynthese zur fortschrittlichen Biomaterialentwicklung. Adv Mater, 31(1), e1801651. doi:10.1002/adma.201801651
- Uzawa, K., Kasamatsu, A. & Yamauchi, M. (2023). Kollagenvernetzung bei Mundkrebs. Oral Science International, 21. doi:10.1002/osi2.1182
- van der Rest, M. & Garrone, R. (1991). Kollagenfamilie von Proteinen. Faseb j, 5(13), 2814-2823.
- Von Der Mark, K. (2006). KAPITEL 1 – Struktur, Biosynthese und Genregulation von Kollagenen in Knorpel und Knochen. In MJ Seibel, SP Robins und JP Bilezikian (Hrsg.), Dynamik des Knochen- und Knorpelstoffwechsels (XNUMX. Auflage) (S. 3-40). Burlington: Akademische Presse.
- Wolff, K., Goldsmith, LA, Katz, SI, Gilchrest, BA, Paller, AS, & Leffell, DJ (2008). Fitzpatricks Dermatologie in der Allgemeinmedizin: McGraw-Hill New York.
- YANG, CL, RUI, H., MOSLER, S., NOTBOHM, H., SAWARYN, A. & MÜLLER, PK (1993). Kollagen II aus Gelenkknorpel und Anulus fibrosus: Strukturelle und funktionelle Auswirkungen gewebespezifischer posttranslationaler Modifikationen von Kollagenmolekülen. Europäische Zeitschrift für Biochemie, 213(3), 1297-1302.
