Kollagen ist wie der Bautrupp des Körpers – ein Protein aus Aminosäuren, das die Körperstrukturen zusammenhält. Es hat Vorteile wie die Verbesserung der Gelenkgesundheit und der Weichgeweberegeneration sowie die Verbesserung der Hautgesundheit. Wenn Sie sich jedoch dafür entscheiden, Ihrer Routine ein Kollagenpräparat hinzuzufügen, was ist dann am besten: Kollagen oder Kollagenpeptide?
Kollagenpeptide sind Kollagen, das in kleinere „Stränge“ zerlegt wird. Dieser Abbauprozess verändert die funktionellen Eigenschaften und möglicherweise die Bioverfügbarkeit (Absorptionsfähigkeit) von Kollagen. Allerdings können sowohl Kollagen als auch Kollagenpeptide für die Gesundheit und Genesung nützlich und wirksam sein, und Ihr Magen kann Kollagen in Ihrem Magen auch in Peptide abbauen.
In den meisten Studien mit Kollagen werden Kollagenpeptide verwendet, und es wird allgemein empfohlen, in Kollagenpeptide zu investieren, die über dem normalen Kollagen liegen.
Natürlich kommt es auf den Kontext an, also lassen Sie uns einen Blick auf die Literatur zu Kollagen und Kollagenpeptiden und den Unterschieden zwischen beiden werfen.
Inhaltsverzeichnis
Kollagen verstehen
Kollagen ist ein grundlegendes Protein im menschlichen Körper und macht etwa ein Drittel des gesamten Proteingehalts aus. Im Gegensatz zu Molkenprotein, das die Muskelmasse erheblich steigert, spielt es eine entscheidende Rolle bei der Aufrechterhaltung der mechanischen Eigenschaften des Bindegewebes und der Hautgesundheit [1].
Kollagen ist ein wichtiger Akteur in der extrazellulären Matrix (ECM), die wie ein entscheidendes Gerüst dafür sorgt, dass das Gewebe stark, reguliert und in der Lage bleibt, sich selbst zu reparieren [2].
Die Gesundheit der Sehnen, die für die Funktion des Bewegungsapparates von entscheidender Bedeutung sind, wird maßgeblich durch Kollagen beeinflusst, das etwa 65–80 % seines Trockengewichts ausmacht.
Kollagenvernetzungen innerhalb von Sehnen tragen maßgeblich zur Stärkung der strukturellen Integrität bei und ermöglichen die Widerstandsfähigkeit gegenüber starken Belastungen und Scherkräften, was insbesondere im Sportkontext relevant ist [3].
Kollagen hat aufgrund der drei wichtigen Aminosäuren Glycin, Prolin und Hydroxyprolin eine einzigartige Struktur, die einer Dreifachhelix ähnelt [4].
Wenn Kollagen einer enzymatischen Hydrolyse unterzogen wird, verwandelt es sich in kleinere bioaktive Peptide, die häufig in Kollagenpräparaten vorkommen.
Diese Peptide werden im Verdauungstrakt leicht absorbiert, bevor sie in den Blutkreislauf gelangen [5].
Kollagen kann aus verschiedenen Quellen stammen, z. B. von Rindern (Kühen), Schweinen (Schweinen), Meerestieren (Fischen) und Geflügel (Hühnern). [4].
Was sind Kollagenpeptide?
Zunächst einmal: Was sind Peptiden? Peptide sind kurze Aminosäureketten, die als Grundbausteine von Proteinen dienen.
Peptidbindungen binden Aminosäuren, wodurch Peptide entstehen – fast wie eine Perlenkette. Diese Peptide können sich dann zu einem Protein verbinden.
Was passiert nun, wenn wir diesen Prozess umdrehen? Wenn Kollagen, eine Art Protein, abgebaut wird, wandelt es sich in Peptide um.
Dieser Abbau erfolgt mit Hilfe von Enzymen. Diese resultierenden Kollagenpeptide weisen eine hohe Absorptionsfähigkeit auf.
Aufgrund des enzymgesteuerten Abbaus unterscheiden sich Kollagenpeptide von Gelatine dadurch, dass sie bei der Aufnahme in Wasser keine gelartige Konsistenz erzeugen und sich daher vollständig auflösen.
Kollagen vs. Kollagenpeptide: Die Unterschiede aufschlüsseln

Zusammensetzung und Struktur
Kollagen:
- Kollagen liegt zunächst in einer Proteinstruktur voller Länge vor.
- Dreifachhelix-Struktur
- Diese Form ist im Wesentlichen der natürliche Zustand von Kollagen im Körper.
Kollagenpeptide:
- Durch enzymatische Hydrolyse (Abbau) wandelt sich Kollagen um.
- Wenn Kollagen hydrolysiert wird, verändert sich seine Struktur aufgrund des Aufbrechens von Wasserstoffbrückenbindungen von einer Dreifachhelix zu einer zufälligen Spirale.
- Dieser Prozess führt zur Bildung von Kollagenpeptiden, die durch kleinere, zerbrochene Ketten gekennzeichnet sind.
- Kollagenpeptide unterscheiden sich von der ursprünglichen Proteinstruktur voller Länge und sind daher leichter resorbierbar.
Das Bild unten zeigt, wie Kollagen in Peptide zerlegt wird („natives“ Kollagen bedeutet, dass es unverändertes, „normales“ Kollagen ist) und wie sich ihre Strukturen im Laufe des Prozesses verändern:
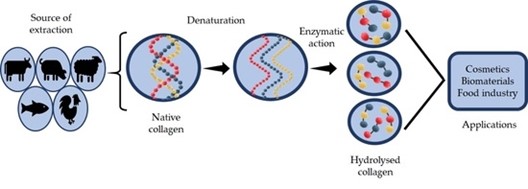
Abbildung 1: Der Abbau von Kollagen [6]
Absorption und Bioverfügbarkeit
Insgesamt sind Kollagenpeptide möglicherweise bioverfügbarer als ganzes Kollagen, da sie bereits abgebaut sind. Es liegen jedoch nur begrenzte Forschungsergebnisse zum Vergleich von Kollagen mit Kollagenpeptiden vor.
Viele Studien verwenden jedoch Kollagenpeptide anstelle von „normalem Kollagen“, um die Auswirkungen von Kollagen auf die Gesundheit zu untersuchen.
Ihr Magen enthält außerdem Enzyme, die Kollagen in Peptide aufspalten können. Selbst wenn Sie regelmäßig Kollagen zu sich nehmen, profitieren Sie dennoch von seinen Vorteilen.
Funktionelle Eigenschaften
Die Zusammensetzung und der Grad der Hydrolyse (Abbau durch Enzyme) beeinflussen die funktionellen Eigenschaften von Kollagen, wie z. B. die antioxidative Kapazität und die antimikrobielle Aktivität.
Diese Eigenschaften werden hauptsächlich durch das Molekulargewicht des Kollagens beeinflusst [7, 8].
Ähnlichkeiten zwischen Kollagen und Kollagenpeptiden
Sowohl Kollagen als auch Kollagenpeptide bringen die Vorteile der Kollageneinnahme mit sich, wie z. B. eine bessere Hautgesundheit, eine verbesserte Gelenkgesundheit und die Heilung von Weichteilverletzungen – weder Kollagen noch Kollagenpeptide bilden Gele, wenn sie in Wasser gelöst werden.
Nur Gelatine, die durch Wärmebehandlung und den enzymatischen Abbau von Kollagen entsteht, bildet beim Auflösen in Wasser ein Gel [9].
Sowohl Kollagen als auch Kollagenpeptide sind geschmacksneutral, es sei denn, sie sind in einem Produkt mit mehr Inhaltsstoffen enthalten.
Zusammenfassung
Bei der Wahl zwischen Kollagen und Kollagenpeptiden wirken sich beide auf ähnliche Weise positiv auf Ihre Gesundheit und Leistungsfähigkeit aus. Wenn Ihr Budget es zulässt, können Sie sich jedoch für Kollagenpeptide entscheiden, die möglicherweise bioverfügbarer sind und andere funktionelle Vorteile bieten.
Bibliographie
- Frantz, C., Stewart, KM, & Weaver, VM (2010). Die extrazelluläre Matrix auf einen Blick. J Cell Sci, 123(Teil 24), 4195-4200. doi:10.1242/jcs.023820
- Iwai, K., Hasegawa, T., Taguchi, Y., Morimatsu, F., Sato, K., Nakamura, Y., . . . Ohtsuki, K. (2005). Identifizierung von aus Lebensmitteln stammenden Kollagenpeptiden im menschlichen Blut nach oraler Einnahme von Gelatinehydrolysaten. J Agrarlebensmittelchemie, 53(16), 6531-6536. doi:10.1021/jf050206p
- Kjaer, M. (2004). Rolle der extrazellulären Matrix bei der Anpassung von Sehnen und Skelettmuskeln an mechanische Belastungen. Physiol Rev, 84(2), 649-698. doi:10.1152/physrev.00031.2003
- León-López, A., Morales-Peñaloza, A., Martínez-Juárez, VM, Vargas-Torres, A., Zeugolis, DI, & Aguirre-Álvarez, G. (2019). Hydrolysiertes Kollagen – Quellen und Anwendungen. Moleküle, 24(22). doi:10.3390/molecules24224031
- León-López, A., Morales-Peñaloza, A., Martínez-Juárez, VM, Vargas-Torres, A., Zeugolis, DI, & Aguirre-Álvarez, G. (2019). Hydrolysiertes Kollagen – Quellen und Anwendungen. Moleküle, 24(22), 4031. Abgerufen von https://www.mdpi.com/1420-3049/24/22/4031
- Li, Z., Wang, B., Chi, C., Gong, Y., Luo, H. & Ding, G. (2013). Einfluss des durchschnittlichen Molekulargewichts auf die antioxidativen und funktionellen Eigenschaften von Knorpelkollagenhydrolysaten aus Sphyrna lewini, Dasyatis akjei und Raja porosa. Lebensmittelforschung International, 51(1), 283-293.
- Mokrejš, P., Gál, R. & Pavlačková, J. (2023). Enzymkonditionierung von Hühnerkollagen und Taguchi. Versuchsplanung zur Verbesserung der Ausbeute und Qualität vorbereiteter Gelatine. Int J Mol Sci, 24(4). doi:10.3390/ijms24043654
- Ricard-Blum, S. (2011). Die Kollagenfamilie. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
- Zhang, Y., Zhang, Y., Liu, X., Huang, L., Chen, Z. & Cheng, J. (2017). Einfluss des Hydrolyseverhaltens und der Mikrofluidisierung auf die Funktionalität und Struktureigenschaften von Kollagenhydrolysaten. Lebensmittelchemie, 227, 211-218.
