Protein ist ein wichtiger Bestandteil der Ernährung eines Sportlers, da es die Bausteine des Gewebes im Körper bildet. Aber was ist die beste Wahl für einen Sportler: Kollagen oder Molkenprotein?
Sowohl Kollagen als auch Molkenprotein sind wirksam, allerdings aus unterschiedlichen Gründen. Es hat sich gezeigt, dass Kollagen die Stärke und Regeneration von Sehnen und Bändern wirksamer steigert, während Molke wirksamer für den Muskelaufbau ist.
Um zu verstehen, welches Protein für Ihre Ziele am besten geeignet ist, ist es wichtig zu wissen, wie es funktioniert und welche Unterschiede zwischen den beiden Proteinarten bestehen.
Inhaltsverzeichnis
Was ist Kollagenprotein?

Kollagen macht 30 % des Proteins Ihres Körpers aus und ist das am häufigsten vorkommende Protein in Ihrem Körper [1]. Alle Proteine bestehen aus Bausteinen, die „Aminosäuren“ genannt werden.
Kollagen besteht aus den Aminosäuren Glycin, Prolin, Lysin, Hydroxylysin und Hydroxyprolin, die sich zu einer Einheit namens „Polypeptidketten“ zusammenfügen.
Kollagen besteht aus drei Polypeptidketten, die üblicherweise als α-Ketten bezeichnet werden. Diese Ketten sind mit arabischen Ziffern nummeriert [2].
Die Grundeinheit von Kollagen ist eine Dreifachhelix-Struktur, die durch die Verflechtung dieser drei Polypeptidketten entsteht [3].
Wenn das etwas komplex klingt, stellen Sie es sich so vor: Die Dreifachhelix-Struktur von Kollagen ist wie ein dicht gewebtes Kabel, bei dem drei einzelne Fäden, die die Polypeptidketten darstellen, ineinander verschlungen und verdreht sind und so ein elastisches und starkes Band bilden, das das Rückgrat der Unterstützung bildet im Bindegewebe Ihres Körpers.
Kollagen ist ein faseriges Protein und der Hauptbestandteil von Bindegeweben wie Sehnen, Bändern, Haut und Knochen. Es verleiht verschiedenen Strukturen im Körper Festigkeit und Halt.
28 Arten von Kollagen bilden zusammen verschiedene komplexe Strukturen.
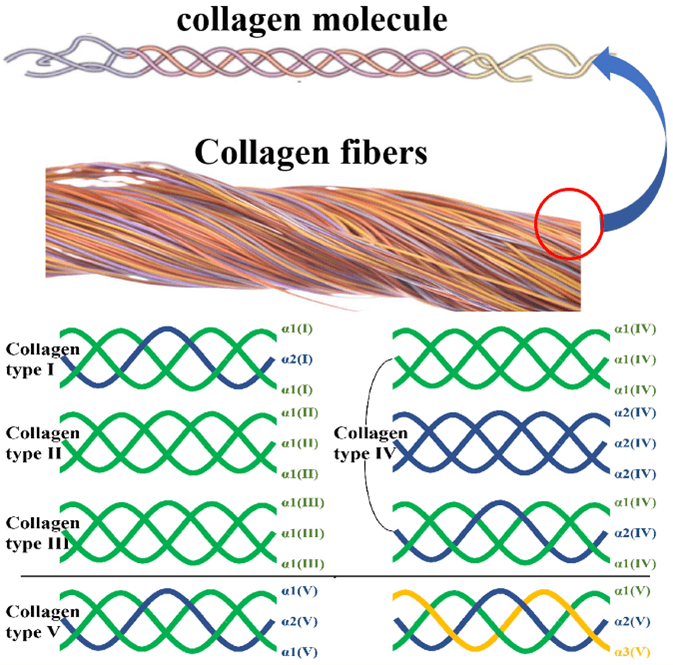
Abbildung 1: Struktur von Kollagen [4]
Was ist Molkenprotein?

Molkenprotein ist ein hochwertiges Protein, das bei der Käseherstellung aus Milch gewonnen wird. Es entsteht als Nebenprodukt bei der Trennung von Milch in Quark und Molke.
Molkenprotein ist reich an essentiellen Aminosäuren, also Proteinen, die der Körper nicht selbst herstellen kann.
Es ist in Pulverform erhältlich und wird häufig in Shakes und Smoothies verwendet oder zu Lebensmitteln hinzugefügt, um die Proteinaufnahme bequem und effektiv zu erhöhen.
Es gibt 9 essentielle Aminosäuren, also Aminosäuren, die der Körper nicht selbst herstellen kann: Histidin, Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan und Valin, die jeweils eine entscheidende Rolle bei verschiedenen physiologischen Funktionen im menschlichen Körper spielen [5].
Unterschiede zwischen Kollagen und Molkenprotein

Proteinqualität
Der „Protein Digestibility-Corrected Amino Acid Score“ (PDCAAS) misst die Proteinqualität in der Wissenschaft.
Dabei geht es um die Menge an essentiellen Aminosäuren, die Fähigkeit des Proteins, alle 9 essentiellen Aminosäuren bereitzustellen, und die Verdaulichkeit dieser Aminosäuren.
Die Skala reicht von 0 bis 1, wobei 1 die höchste Proteinqualität angibt.
Molkenprotein hat typischerweise einen PDCAAS von 1, da es alle essentiellen Aminosäuren in ausreichender Menge enthält und gut verdaulich ist.
Molke gilt als vollständige Proteinquelle und ist daher eine ausgezeichnete Wahl zur Unterstützung des Muskelwachstums und der Muskelregeneration.
Umgekehrt ist Kollagen kein vollständiges Protein, da ihm bestimmte essentielle Aminosäuren, insbesondere Tryptophan und Isoleucin, fehlen.
Daher hat Kollagen im Allgemeinen einen niedrigeren PDCAAS als Molkenprotein.
Kollagen unterstützt jedoch speziell die Gesundheit von Bindegewebe, Haut und Gelenken und ist keine primäre Quelle für vollständiges Protein.
Muskelaufbau und Körperzusammensetzung

Collagen
Kollagen enthält reichlich nicht-essentielle Aminosäuren wie Prolin und Glycin, aber es fehlen essentielle Aminosäuren wie Leucin, das ein Hauptstimulator der Muskelproteinsynthese ist [6].
Während bestimmte Studien darauf hindeuten, dass die Einnahme von Kollagen die Muskelmasse steigern kann, ergab eine systematische Überprüfung von 15 Studien, dass junge, freizeitaktive Personen zeigten bei einer Kollagenergänzung mit 15 g/Tag und Krafttraining keine so wesentlichen Veränderungen in der Körperzusammensetzung und Kraft wie bei älteren Männern mit Sarkopenie [7] (ältere Männer verlieren Muskeln).
Eine Hypothese besagt, dass Kollagenprotein das Muskelbindegewebe nach dem Training stärken kann. In einer neuen Studie [8] Beim Vergleich von Molkenprotein und Kollagen nahmen 45 gesunde junge Männer und Frauen nach einer einzigen Widerstandsübung entweder 30 g Molkenprotein, 30 g Kollagenprotein oder ein kalorienfreies Placebo zu sich.
Die Langhantel-Kniebeuge-Übung erhöhte die Synthese sowohl von kontraktilen (Proteine, die den Muskelkontakt unterstützen) als auch von Bindeproteinen (Proteine, die Bindegewebe bilden).
Die Einnahme von Molkenprotein steigerte die Synthese kontraktiler Proteine weiter, hatte jedoch überraschenderweise keinen Einfluss auf Bindeproteine.
Die Einnahme von Kollagenprotein hatte keinen Einfluss auf die Synthese kontraktiler Proteine oder des Bindegewebes.
Während einige Studien positive Ergebnisse für die Kollagenergänzung in Sehnen und Knochen zeigen, deutet diese Studie auf minimale Auswirkungen auf das Muskelbindegewebe hin.
Die Einnahme von Molkenprotein kann die Synthese kontraktiler Proteine steigern, während die Einnahme von Kollagenprotein die Synthese von Bindeproteinen nicht beeinflusst [8].
Molkenprotein
Molkenproteinpräparate enthalten Peptide, die für ihre antioxidativen Eigenschaften bekannt sind [9] und das Sättigungsgefühl steigern [10].
Molke gilt als hochwertiges Nahrungsprotein und ist reich an verzweigtkettigen Aminosäuren (BCAAs), insbesondere Leucin, die für den Erhalt der Muskelmasse während der Gewichtsabnahme und die Verbesserung der Muskelproteinsynthese von entscheidender Bedeutung sind [11].
Aus diesen Gründen haben zahlreiche Studien gezeigt, dass Molkenprotein sich positiv auf den Muskelaufbau auswirkt [12, 13, 14].
In einer randomisierten kontrollierten Studie mit 22 ältere DameEs wurde festgestellt, dass Molkenprotein, nicht jedoch Kollagen, den Skelettmuskelaufbau verbesserte, wenn es über mehrere Tage gemessen wurde [15].
Timing und Dosis

Collagen
Die Wirksamkeit von Kollagen hängt stark vom Zeitpunkt ab. In einigen Studien wird Gelatine als Kollagenquelle verwendet, da sie ähnliche Aminosäuren wie Kollagen enthält [16].
Es wird empfohlen, 15 – 30 Minuten vor dem Training 60 g Gelatine oder Kollagen in flüssiger oder Gelform mit einer Vitamin-C-Quelle einzunehmen, die ergänzend (Sprudel oder Tablette) oder natürlich (Orangensaft/Erdbeersaft usw.) sein kann.
Die genaue Menge an Kollagen kann vom Körpergewicht abhängen. Wenn Sie sich nicht sicher sind, wird empfohlen, mit einem Arzt oder Ernährungsberater zu sprechen, um die optimale Dosis für Sie zu ermitteln [17, 18].
Whey Protein
Zwischen 1 und 4 Stunden nach der Mahlzeit kommt es zu einem Anstieg der Muskelproteinsynthese, was zu einem günstigen Muskelproteingleichgewicht führt.
Umgekehrt verringert sich in Zeiten ohne Nahrungsaufnahme die Geschwindigkeit der Muskelproteinsynthese, was zu einer negativen Muskelproteinbilanz führt.
Deshalb ist es wichtig, Ihr Protein gleichmäßig über den Tag zu verteilen, etwa alle 3 – 4 Stunden eine Proteinquelle zu sich zu nehmen, mit einer empfohlenen Menge von 20 – 25 g pro Mahlzeit [11, 19].
- Nach dem Training
Neue Studien deuten darauf hin, dass das Hinzufügen von Proteinen und Kohlenhydraten zu Ihrer Ernährung nach intensiven Ausdauer- und Widerstandsübungen die Muskelproteinsynthese verbessern kann [20].
Aus diesem Grund wird die Zeit nach dem Training oft als „anaboles Fenster“ bezeichnet.
Dennoch ist das anabole Fenster wahrscheinlich länger als bisher angenommen, da die Muskeln offenbar bis zu 24 Stunden nach dem Training für Protein empfänglich bleiben. [21].
Es ist einfacher, direkt nach dem Training daran zu denken, Protein einzunehmen. Es bietet die Möglichkeit, Proteine über den Tag zu verteilen, daher kann es von Vorteil sein, wenn man versucht, Proteine kurz nach dem Training einzunehmen.
Der Verzehr von Protein nach dem Training, insbesondere wenn die Kohlenhydrataufnahme unter dem optimalen Niveau liegt (<1.2 g/kg/Tag), kann die Erholung von Muskelglykogen verbessern und möglicherweise Muskelschäden nach dem Training reduzieren [11].
- Während des Trainings

Während der Verzehr von Proteinen während des Trainings keine Leistungssteigerung bewiesen hat, deuten Studien darauf hin, dass es die Indikatoren für Muskelschäden nach dem Training innerhalb von 12 bis 24 Stunden reduzieren und Muskelkater nach dem Training lindern kann [22, 23, 24].
Es wird empfohlen, dass Sportler pro Stunde Training etwa 0.25 g Protein pro kg Körpergewicht zu sich nehmen [23].
- Snack vor dem Zubettgehen
Zahlreiche Studien haben berichtet, dass der Verzehr von 20 – 30 g Protein 30 – 90 Minuten vor dem Schlafengehen die Muskelproteinsynthese steigern kann, ohne dass es zu einer Fettzunahme kommt [25, 26, 27].
Die empfohlene tägliche Proteindosis (RDA) liegt derzeit bei 0.8 g/kg/Tag, ist für Sportler jedoch möglicherweise nicht ausreichend. Frühere Empfehlungen von 1.2–1.3 g/kg/Tag könnten den Bedarf unterschätzt haben.
Der Proteinbedarf hängt von Faktoren wie Bewegung, Alter, Körperzusammensetzung und Energieaufnahme ab.
Als Mindestmenge gilt eine tägliche Zufuhr von 1.4 bis 2.0 g/kg/Tag, höhere Mengen gelten für diejenigen, die die Kalorienzufuhr einschränken und gleichzeitig die Muskulatur erhalten.
Die Empfehlungen variieren je nach Alter und kürzlich durchgeführtem Widerstandstraining für eine optimale Muskelproteinsynthese und schlagen typischerweise 0.25 g/kg oder eine absolute Dosis von 20–40 g pro Portion vor.
Ältere Personen können von höheren Dosen (ca. 40 g) profitieren, und möglicherweise sind sogar noch mehr (ca. 70 g) erforderlich, um den Muskelproteinabbau wirksam zu reduzieren.
- Gesamtbetrag pro Tag
Eine systematische Überprüfung von 49 Studien zeigte, dass 1.6 g/kg Protein pro Tag die Muskelmasse beim Krafttraining bei gesunden Erwachsenen effektiv steigerten [36].
Für Sportler mit einem großen Kaloriendefizit kann eine höhere Proteinzufuhr von Vorteil sein, um die Muskelmasse zu erhalten – bis zu 2.3 – 3.1 g/kg fettfreie Masse pro Tag [37].
Eine abschließende Studie hat gezeigt, dass die Aufnahme von mehr als dem 5.5-fachen der empfohlenen Tagesdosis (bis zu 4 g/kg) bei einem Überschuss (die Aufnahme von mehr Kalorien, als Sie jeden Tag benötigen) nicht zu einer Fettmassezunahme führt, was diese Strategie zu einer großartigen Strategie macht beim Muskelaufbau [38].
Sehnenreparatur

Collagen
Die Struktur und Funktion von Geweben wie Sehnen, Bändern, Knorpel und Knochen beruht auf ihrer kollagenreichen Matrix.
Diese Matrix, die den nichtzellulären Bestandteil dieser Gewebe darstellt, wird durch Faktoren wie die Menge an Kollagen, die Vernetzung und den Gewebegehalt (Wasser oder Mineralien) beeinflusst. [28, 29].
Krankheiten oder ernährungsbedingte/genetische Probleme können diese Matrix beeinträchtigen und dazu führen, dass das Gewebe nicht mehr in der Lage ist, normale Aktivitäten zu bewältigen [30].
Richtige Ernährung und Bewegung verbessern im Allgemeinen die Matrixfunktion. Akute sportliche Betätigung fördert die Kollagensynthese und die Expression eines Enzyms, das für die Kollagenstärke entscheidend ist.
Dadurch wird das Gewebe nach dem Training dichter, steifer und stärker und kann höheren Belastungen standhalten [31, 32].
In einer Studie mit acht gesunden Männern [17]Die Teilnehmer nahmen drei Tage lang entweder 5 oder 15 g mit Vitamin C angereicherte Gelatine oder ein Placebo ein.
Es wurden Blutproben entnommen, um die Aminosäuren zu überprüfen, und größere Proben wurden vor und nach der Gelatineeinnahme entnommen, um manipulierte Bänder zu behandeln.
Anschließend absolvierten die Teilnehmer dreimal täglich 6-minütige Seilspringsitzungen mit einer Pause von 6 Stunden. Die Ergebnisse zeigten einen Anstieg der Aminosäuren nach der Einnahme von Gelatine.
Mit Serum von Gelatinekonsumenten behandelte Bänder hatten mehr Kollagen und eine bessere Mechanik. Diejenigen, die vor dem Training 15 g Gelatine einnahmen, hatten doppelt so viele Kollagensynthesemarker im Blut.
Dies deutet darauf hin, dass die Zugabe von Gelatine zu intermittierendem Training die Kollagensynthese steigern und möglicherweise zur Verletzungsprävention und Gewebereparatur beitragen kann.
Durch die Vernetzung von Kollagen erhöht sich die Dichte der Matrix, was wiederum die Steifigkeit der Sehnen und damit die Kraftübertragung erhöht.
Zum Beispiel in einer dreiwöchigen Studie [18]50 gesunden jungen männlichen Sportlern wurde vor ihrem Krafttraining entweder mit Vitamin C angereichertes Kollagen oder ein Placebo verabreicht.
Die Gruppe, die hydrolysiertes Kollagen und Vitamin C erhielt, nahm täglich 20 Gramm Kollagen und 50 Milligramm Vitamin C ein, während die Placebogruppe Maltodextrin erhielt.
Beide Gruppen absolvierten das gleiche Muskelkrafttrainingsprogramm. Die Forscher haben während der gesamten Studie die Geschwindigkeit der Kraftentwicklung (RFD) und andere Leistungsindikatoren gemessen.
Die Ergebnisse zeigten, dass die maximale RFD der Kollagen- und Vitamin-C-Gruppe auf das Ausgangsniveau zurückkehrte, während die Placebo-Gruppe niedriger blieb.
Am Ende der Studie hatte nur die Kollagen- und Vitamin-C-Gruppe ihre RFD vollständig wiederhergestellt. Die Kollagen- und Vitamin-C-Gruppe zeigte auch Verbesserungen bei bestimmten sprungbezogenen Maßnahmen.
Dies deutet darauf hin, dass eine mit Vitamin C angereicherte Kollagenergänzung die Muskelkraft und den Kraftaufbau während des Krafttrainings unterstützen könnte.
Molkenprotein
Für die Rolle von Molkenprotein speziell bei der Sehnenreparatur liegen weniger Belege vor.
Eine Studie ergab, dass Molkenprotein das Sehnenwachstum während des Krafttrainings fördern kann [33]. Die Rolle von Molke wird dadurch bestätigt, dass Ratten nach fünfwöchiger Leucin-Supplementierung nach Unterernährung ein ähnliches Sehnenwachstum zeigten [34].
Es ist jedoch unklar, ob dies direkt in der Sehne geschieht oder ob es daran liegt, dass die Muskeln größer und stärker werden.
Laktose, Milchprodukte und andere Allergene

Molkenprotein
Da Molkenprotein ein Nebenprodukt bei der Käseherstellung ist, enthält es häufig Laktose. Wenn Sie eine Laktoseintoleranz haben, kann die Entscheidung für Molkenproteinisolat das Risiko von Beschwerden verringern.
Bei einer Proteinreinheit von mindestens 90 % enthält die Endzutat nur minimal bis gar keine Laktose.
Bei einer Kuhmilchallergie ist es besser, auf Molkenprotein zu verzichten und stattdessen auf pflanzliche Proteinpräparate wie Soja zu setzen.
Molkenprotein enthält Proteine, die in Kuhmilch vorkommen, und bei Personen mit einer Milchproteinallergie können Nebenwirkungen, einschließlich allergischer Reaktionen, auftreten.
Es ist wichtig, einen Arzt oder Allergologen zu konsultieren, um die am besten geeigneten Proteinoptionen basierend auf individuellen Allergien und Ernährungsbedürfnissen zu ermitteln.
Collagen
Kollagen enthält keine Laktose. Wenn Sie jedoch Allergien haben, sollten Sie bei der Einnahme von Kollagenpräparaten ebenfalls vorsichtig sein.
Kollagenpräparate werden häufig aus tierischen Quellen gewonnen, beispielsweise aus Rinder- (Rind), Schweine- (Schwein) oder Meereskollagen (Fisch).
Bei Personen mit spezifischen Allergien gegen diese Quellen kann es zu allergischen Reaktionen auf Kollagenpräparate kommen.
Lesen Sie die Produktetiketten sorgfältig durch und wählen Sie Kollagenpräparate, auf denen die Quelle ausdrücklich angegeben ist.
Es sind auch Kollagenpräparate erhältlich, die als hypoallergen gekennzeichnet sind oder speziell zur Minimierung des allergenen Potenzials entwickelt wurden.
Die individuellen Reaktionen auf diese Produkte können jedoch unterschiedlich sein, und es ist ratsam, professionellen Rat einzuholen, um die Sicherheit der Kollagenergänzung für Personen mit Allergien zu gewährleisten.
Sollten Sie Kollagen oder Molkenprotein verwenden?
Die beiden Produkte haben unterschiedliche Aminosäureprofile und werden anschließend aus unterschiedlichen Gründen eingesetzt. Molkenprotein ist ein klarer Gewinner für den Muskelaufbau und die Muskelregeneration.
Für die Stärkung der Sehnen und die Erholung von Gewebeverletzungen wäre Kollagen die beste Wahl, aber es ist wichtig, es 30 – 60 Minuten vor dem Training mit einer Vitamin-C-Quelle einzunehmen, um die Wirksamkeit zu erhöhen.
Bibliographie
1. Antonio, J., Peacock, CA, Ellerbroek, A., Fromhoff, B. & Silver, T. (2014). Die Auswirkungen einer proteinreichen Ernährung (4.4 g/kg/Tag) auf die Körperzusammensetzung bei Personen mit Krafttraining. J Int Soc Sports Nutr, 11, 19. doi:10.1186/1550-2783-11-19
2. Aussieker, T., Hilkens, L., Holwerda, AM, Fuchs, CJ, Houben, LHP, Senden, JM, . . . LJC, VANL (2023). Die Einnahme von Kollagenprotein während der Erholung nach dem Training erhöht nicht die Syntheseraten von Muskelbindeproteinen. Med Sci Sportübung, 55(10), 1792-1802. doi:10.1249/mss.0000000000003214
3. Baar, K. (2017). Verletzungen minimieren und Rückkehr zum Spiel maximieren: Lehren aus konstruierten Bändern. Sportmed, 47(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
4. Barbosa, AW, Benevides, GP, Alferes, LM, Salomão, EM, Gomes-Marcondes, MC, & Gomes, L. (2012). Eine leucinreiche Ernährung und Bewegung beeinflussen die biomechanischen Eigenschaften der digitalen Beugesehne bei Ratten nach der Ernährungserholung. Aminosäuren, 42(1), 329-336. doi:10.1007/s00726-010-0810-1
5. Bühler, MJ (2008). Nanomechanik von Kollagenfibrillen bei unterschiedlichen Vernetzungsdichten: Atom- und Kontinuumsstudien. J Mech Behav Biomed Mater, 1(1), 59-67. doi:10.1016/j.jmbbm.2007.04.001
6. Burd, NA, West, DW, Moore, DR, Atherton, PJ, Staples, AW, Prior, T., . . . Phillips, SM (2011). Die erhöhte Aminosäuresensitivität der myofibrillären Proteinsynthese bleibt bei jungen Männern bis zu 24 Stunden nach einem Widerstandstraining bestehen. J Nutr, 141(4), 568-573. doi:10.3945/jn.110.135038
7. Churchward-Venne, T. & Burd, N. (2012). Ergänzung einer suboptimalen Proteindosis mit Leucin oder EAAs: Auswirkungen der myofibrillären Proteinsynthese in Ruhe und nach Widerstandsübungen bei Männern. Journal of Physiology.
8. Coffey, VG, Moore, DR, Burd, NA, Rerecich, T., Stellingwerff, T., Garnham, AP, . . . Hawley, JA (2011). Die Nährstoffversorgung steigert die Signalübertragung und Proteinsynthese im menschlichen Skelettmuskel nach wiederholten Sprints. Eur J Appl Physiol, 111(7), 1473-1483. doi:10.1007/s00421-010-1768-0
9. Couppé, C., Kongsgaard, M., Aagaard, P., Hansen, P., Bojsen-Moller, J., Kjaer, M. & Magnusson, SP (2008). Gewohnheitsmäßige Belastung führt zu einer Sehnenhypertrophie und einer erhöhten Steifheit der menschlichen Patellasehne. J Appl Physiol (1985), 105(3), 805-810. doi:10.1152/japplphysiol.90361.2008
10. Devries, MC, McGlory, C., Bolster, DR, Kamil, A., Rahn, M., Harkness, L., . . . Phillips, SM (2018). Der Leucingehalt und nicht der Gesamtproteingehalt eines Nahrungsergänzungsmittels ist der Hauptfaktor für die anabolen Reaktionen des Muskelproteins bei gesunden älteren Frauen. Das Journal of Nutrition, 148(7), 1088-1095.
11. Farup, J., Rahbek, SK, Vendelbo, MH, Matzon, A., Hindhede, J., Bejder, A., . . . Vissing, K. (2014). Molkenproteinhydrolysat steigert die Sehnen- und Muskelhypertrophie unabhängig vom Kontraktionsmodus des Widerstandstrainings. Scand J Med Sci Sports, 24(5), 788-798. doi:10.1111/sms.12083
12. Heinemeier, KM, Olesen, JL, Haddad, F., Schjerling, P., Baldwin, KM, & Kjaer, M. (2009). Auswirkung von Entladung und anschließender Neubeladung auf die Expression von Kollagen und verwandten Wachstumsfaktoren in Sehnen und Muskeln von Ratten. J Appl Physiol (1985), 106(1), 178-186. doi:10.1152/japplphysiol.91092.2008
13. Helms, ER, Zinn, C., Rowlands, DS, & Brown, SR (2014). Eine systematische Überprüfung des Nahrungsproteins während der Kalorienrestriktion bei Kraftsportlern, die schlank sind: ein Argument für eine höhere Zufuhr. Int J Sport Nutr Exerc Metab, 24(2), 127-138. doi:10.1123/ijsnem.2013-0054
14. Hou, Y. & Wu, G. (2018). Ernährungsphysiologisch essentielle Aminosäuren. Fortschritte in der Ernährung, 9(6), 849-851.
15. Jäger, R., Kerksick, CM, Campbell, BI, Cribb, PJ, Wells, SD, Skwiat, TM, . . . Antonio, J. (2017). Positionsstand der International Society of Sports Nutrition: Protein und Bewegung. J Int Soc Sports Nutr, 14, 20. doi:10.1186/s12970-017-0177-8
16. Kerksick, CM, Wilborn, CD, Roberts, MD, Smith-Ryan, A., Kleiner, SM, Jäger, R., . . . Kreider, RB (2018). Aktualisierung der ISSN-Rezension zu Bewegung und Sporternährung: Forschung und Empfehlungen. J Int Soc Sports Nutr, 15(1), 38. doi:10.1186/s12970-018-0242-y
17. Kerksick, CM, Wismann-Bunn, J., Fogt, D., Thomas, AR, Taylor, L., Campbell, BI, . . . Kreider, RB (2010). Veränderungen des Gewichtsverlusts, der Körperzusammensetzung und des Risikos für Herz-Kreislauf-Erkrankungen nach veränderter Makronährstoffverteilung während eines regelmäßigen Trainingsprogramms bei adipösen Frauen. Nutr J, 9, 59. doi:10.1186/1475-2891-9-59
18. Khatri, M., Naughton, RJ, Clifford, T., Harper, LD und Corr, L. (2021). Die Auswirkungen einer Kollagenpeptid-Supplementierung auf die Körperzusammensetzung, die Kollagensynthese und die Erholung nach Gelenkverletzungen und körperlicher Betätigung: eine systematische Übersicht. Aminosäuren, 53(10), 1493-1506.
19. Kinsey, AW, & Ormsbee, MJ (2015). Die gesundheitlichen Auswirkungen des nächtlichen Essens: alte und neue Perspektiven. Nährstoffe, 7(4), 2648-2662.
20. Kipp, DE, McElvain, M., Kimmel, DB, Akhter, MP, Robinson, RG, & Lukert, BP (1996). Skorbut führt im Meerschweinchen-Tiermodell zu einer verminderten Kollagensynthese und Knochendichte. Knochen, 18(3), 281-288. doi:10.1016/8756-3282(95)00481-5
21. Kjaer, M. (2004). Rolle der extrazellulären Matrix bei der Anpassung von Sehnen und Skelettmuskeln an mechanische Belastungen. Physiol Rev, 84(2), 649-698. doi:10.1152/physrev.00031.2003
22. Lis, DM, Jordan, M., Lipuma, T., Smith, T., Schaal, K. & Baar, K. (2022). Die Ergänzung mit Kollagen und Vitamin C erhöht die Kraftentwicklungsrate der unteren Extremitäten. Int J Sport Nutr Exerc Metab, 32(2), 65-73. doi:10.1123/ijsnem.2020-0313
23. Liu, D., Nikoo, M., Boran, G., Zhou, P. & Regenstein, JM (2015). Kollagen und Gelatine. Annu Rev Food Sci Technol, 6, 527-557. doi:10.1146/annurev-food-031414-111800
24. Oertzen-Hagemann, V., Kirmse, M., Eggers, B., Pfeiffer, K., Marcus, K., de Marées, M. & Platen, P. (2019). Auswirkungen eines 12-wöchigen Hypertrophie-Widerstandstrainings in Kombination mit einer Kollagenpeptid-Supplementierung auf das Skelettmuskel-Proteom bei freizeitaktiven Männern. Nährstoffe, 11(5). doi:10.3390/nu11051072
25. Oikawa, SY, Kamal, MJ, Webb, EK, McGlory, C., Baker, SK, & Phillips, SM (2020). Molkenprotein, aber keine Kollagenpeptide stimulieren die akute und längerfristige Muskelproteinsynthese mit und ohne Widerstandstraining bei gesunden älteren Frauen: eine randomisierte kontrollierte Studie. Am J Clin Nutr, 111(3), 708-718. doi:10.1093/ajcn/nqz332
26. Ricard-Blum, S. (2011). Die Kollagenfamilie. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
27. Romano-Ely, BC, Todd, MK, Saunders, MJ und LAURENT, TS (2006). Einfluss eines isokalorischen Kohlenhydrat-Protein-Antioxidans-Getränks auf die Radfahrleistung. Medizin & Wissenschaft in Sport & Bewegung, 38(9), 1608-1616.
28. Saunders, MJ, Kane, MD, & Todd, MK (2004). Auswirkungen eines Kohlenhydrat-Protein-Getränks auf die Ausdauer beim Radfahren und Muskelschäden. Medizin & Wissenschaft in Sport & Bewegung, 36(7), 1233-1238.
29. Shaw, G., Lee-Barthel, A., Ross, ML, Wang, B. & Baar, K. (2017). Eine mit Vitamin C angereicherte Gelatine-Supplementierung vor intermittierender Aktivität steigert die Kollagensynthese. Am J Clin Nutr, 105(1), 136-143. doi:10.3945/ajcn.116.138594
30. Shoulders, MD, & Raines, RT (2009). Kollagenstruktur und -stabilität. Annu Rev Biochem, 78, 929-958. doi:10.1146/annurev.biochem.77.032207.120833
31. Solah, VA, Kerr, DA, Adikara, CD, Meng, X., Binns, CW, Zhu, K., . . . Prince, RL (2010). Unterschiede in der Sättigungswirkung von Lebensmitteln auf Alginat- und Molkenproteinbasis. Appetit, 54(3), 485-491. doi:10.1016/j.appet.2010.01.019
32. Tang, JE, Moore, DR, Kujbida, GW, Tarnopolsky, MA, & Phillips, SM (2009). Einnahme von Molkenhydrolysat, Kasein oder Sojaproteinisolat: Auswirkungen auf die gemischte Muskelproteinsynthese in Ruhe und nach Krafttraining bei jungen Männern. Zeitschrift für angewandte Physiologie.
33. Trommelen, J. & Van Loon, LJ (2016). Proteineinnahme vor dem Schlafengehen, um die adaptive Reaktion der Skelettmuskulatur auf körperliches Training zu verbessern. Nährstoffe, 8(12), 763.
34. Valentine, RJ, Saunders, MJ, Todd, MK und Laurent, TGS (2008). Einfluss von Kohlenhydrat-Protein-Getränken auf die Radausdauer und Anzeichen von Muskelstörungen. Internationale Zeitschrift für Sporternährung und Bewegungsstoffwechsel, 18(4), 363-378.
35. van der Rest, M. & Garrone, R. (1991). Kollagenfamilie von Proteinen. Faseb j, 5(13), 2814-2823.
36. Xu, R., Liu, N., Xu, X. & Kong, B. (2011). Antioxidative Wirkung von Molkenprotein auf die Peroxid-induzierte Zytotoxizität. J Dairy Sci, 94(8), 3739-3746. doi:10.3168/jds.2010-3891
37. Zhou, N., Liu, Y.-D., Zhang, Y., Gu, T.-W. & Peng, L.-H. (2023). Pharmakologische Funktionen, Synthese und Lieferfortschritt für Kollagen als Bioarzneimittel und Biomaterial. Pharmazie, 15(5), 1443. Abgerufen von https://www.mdpi.com/1999-4923/15/5/1443
