La proteína es una parte vital de la dieta de un atleta porque forma los componentes básicos de los tejidos del cuerpo. Pero, ¿cuál será la mejor opción para un deportista, el colágeno frente a la proteína de suero?
Tanto el colágeno como la proteína de suero son eficaces pero por diferentes motivos. Se ha demostrado que el colágeno es más eficaz para mejorar la fuerza y la recuperación de tendones y ligamentos, mientras que el suero es más eficaz para desarrollar músculo.
Para comprender qué proteína será la más adecuada para sus objetivos, es importante saber cómo funcionan y las diferencias entre los dos tipos de proteínas.
Índice del contenido
¿Qué es la proteína de colágeno?

El colágeno, que constituye el 30% de las proteínas de tu cuerpo, es la proteína más abundante en tu cuerpo. [1]. Todas las proteínas están formadas por componentes básicos llamados "aminoácidos".
El colágeno comprende los aminoácidos glicina, prolina, lisina, hidroxilisina e hidroxiprolina, que se "entrelazan" para formar una unidad llamada "cadenas polipeptídicas".
El colágeno está compuesto por tres cadenas polipeptídicas, comúnmente denominadas cadenas α. Estas cadenas están numeradas con números arábigos. [2].
La unidad básica del colágeno es una estructura de triple hélice formada al entrelazar estas tres cadenas polipeptídicas. [3].
Si esto suena un poco complejo, visualícelo así: la estructura de triple hélice del colágeno es como un cable fuertemente tejido, donde tres hilos individuales, que representan las cadenas polipeptídicas, se entrelazan y retuercen, creando un cordón fuerte y resistente que forma la columna vertebral de soporte. en los tejidos conectivos de su cuerpo.
El colágeno es una proteína fibrosa y es el componente principal de los tejidos conectivos como tendones, ligamentos, piel y huesos, proporcionando fuerza y soporte a diversas estructuras del cuerpo.
28 tipos de colágeno se unen para formar diversas estructuras complejas.
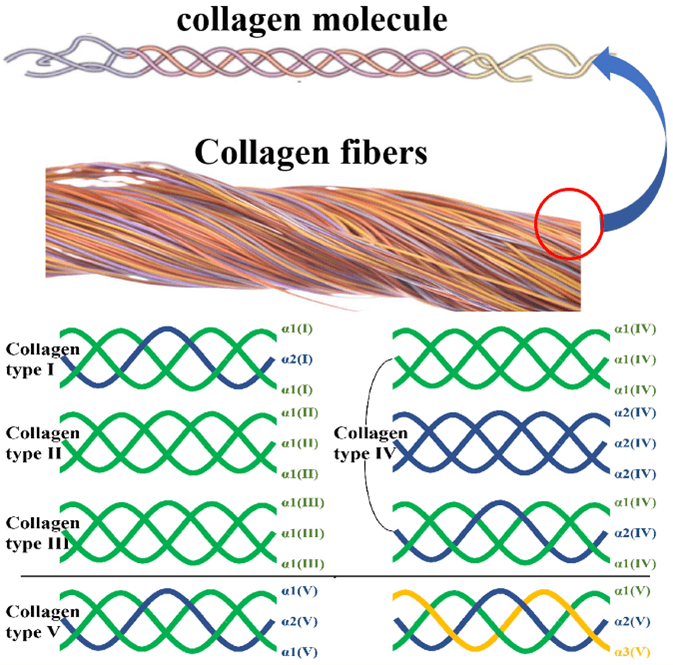
Figura 1: estructura del colágeno [4]
¿Qué es la proteína de suero?

La proteína de suero es una proteína de alta calidad derivada de la leche durante el proceso de elaboración del queso. Es un subproducto de la separación de la leche en cuajada y suero.
La proteína de suero es rica en aminoácidos esenciales, que son proteínas que el cuerpo por sí solo no puede producir.
Está disponible en forma de polvo y se usa comúnmente en batidos y batidos o se agrega a los alimentos como una forma conveniente y efectiva de aumentar la ingesta de proteínas.
Hay 9 aminoácidos esenciales, que son aminoácidos que el cuerpo no puede producir: histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina, cada uno de los cuales desempeña un papel crucial en diversas funciones fisiológicas del cuerpo humano. [5].
Diferencias entre colágeno y proteína de suero

Calidad de la proteína
La “Puntuación de aminoácidos corregida por la digestibilidad de las proteínas” (PDCAAS) mide la calidad de las proteínas en la ciencia.
Analiza la cantidad de aminoácidos esenciales, la capacidad de la proteína para proporcionar los 9 aminoácidos esenciales y la digestibilidad de estos aminoácidos.
La escala va de 0 a 1, donde 1 indica la mayor calidad de proteína.
La proteína de suero normalmente tiene un PDCAAS de 1, ya que contiene todos los aminoácidos esenciales en cantidades adecuadas y es altamente digerible.
El suero se considera una fuente completa de proteínas, lo que lo convierte en una excelente opción para favorecer el crecimiento y la recuperación muscular.
Por el contrario, el colágeno no es una proteína completa porque carece de ciertos aminoácidos esenciales, en particular triptófano e isoleucina.
Como resultado, el colágeno generalmente tiene un PDCAAS más bajo que la proteína de suero.
Sin embargo, el colágeno apoya específicamente la salud de los tejidos conectivos, la piel y las articulaciones en lugar de ser una fuente principal de proteína completa.
Desarrollo muscular y composición corporal

Colágeno
El colágeno contiene abundantes aminoácidos no esenciales como la prolina y la glicina, pero carece de aminoácidos esenciales como la leucina, que es un estimulador primario de la síntesis de proteínas musculares. [6].
Si bien ciertos estudios sugieren que la ingesta de colágeno puede aumentar la masa muscular, una revisión sistemática de 15 estudios encontró que las personas jóvenes y recreativamente activas no mostró cambios tan sustanciales en la composición corporal y la fuerza con 15 g/día de suplementos de colágeno y entrenamiento de resistencia en comparación con los efectos observados en hombres sarcopénicos de edad avanzada [7] (hombres mayores perdiendo músculo).
Una hipótesis ha sido que la proteína de colágeno puede aumentar el tejido conectivo muscular después del ejercicio. En un nuevo estudio [8] Al comparar la proteína de suero y el colágeno, 45 hombres y mujeres jóvenes sanos consumieron 30 g de proteína de suero, 30 g de proteína de colágeno o un placebo sin calorías después de una sola sesión de ejercicio de resistencia.
El ejercicio de sentadilla con barra aumentó la síntesis de proteínas tanto contráctiles (proteínas que ayudan al músculo a entrar en contacto) como conectivas (proteínas que forman tejido conectivo).
La ingesta de proteína de suero mejoró aún más la síntesis de proteínas contráctiles pero, sorprendentemente, no tuvo ningún impacto sobre las proteínas conectivas.
La ingesta de proteínas de colágeno no influyó en la síntesis de proteínas contráctiles ni en el tejido conectivo.
Si bien algunos estudios muestran resultados positivos de la suplementación con colágeno en tendones y huesos, este estudio sugiere un impacto mínimo en el tejido conectivo muscular.
La ingesta de proteína de suero puede aumentar la síntesis de proteínas contráctiles, mientras que la ingesta de proteína de colágeno no influye en la síntesis de proteínas conectivas. [8].
La proteína del suero
Los suplementos de proteína de suero contienen péptidos conocidos por sus propiedades antioxidantes. [9] y mejorar la saciedad [10].
Reconocido como una proteína nutricional de alta calidad, el suero es rico en aminoácidos de cadena ramificada (BCAA), particularmente leucina, crucial para preservar la masa muscular durante la pérdida de peso y mejorar la síntesis de proteínas musculares. [11].
Por estas razones, numerosos estudios han demostrado que la proteína de suero es beneficiosa para el desarrollo muscular. [12, 13, 14].
En un ensayo controlado aleatorio de 22 Mujer mayor, se descubrió que la proteína de suero, pero no el colágeno, mejoraba la construcción del músculo esquelético cuando se midió durante un par de días. [15].
Momento y dosis

Colágeno
La eficacia del colágeno depende en gran medida del momento oportuno. En algunos estudios, la gelatina se utiliza como fuente de colágeno porque contiene aminoácidos similares al colágeno. [16].
Se recomienda tomar 15 g de gelatina o colágeno en forma líquida o en gel 30 – 60 min antes del entrenamiento con una fuente de vitamina C., que puede ser suplementario (gaseoso o en comprimidos) o natural (zumo de naranja/zumo de fresa, etc).
La cantidad exacta de colágeno puede depender del peso corporal y se sugiere hablar con un médico o dietista para encontrar la dosis óptima para usted si no está seguro. [17, 18].
suero proteína
Entre 1 y 4 horas después de una comida, hay una elevación en la síntesis de proteínas musculares, lo que resulta en un equilibrio favorable de proteínas musculares.
Por el contrario, durante los períodos sin ingesta de alimentos, el ritmo de síntesis de proteínas musculares disminuye, lo que lleva a un equilibrio proteico muscular negativo.
Por eso es importante distribuir las proteínas de manera uniforme a lo largo del día, con una fuente de proteína aproximadamente cada 3 – 4h, con una cantidad recomendada de 20 – 25g por comida. [11, 19].
- Después del entrenamiento
Nuevos estudios sugieren que agregar proteínas y carbohidratos a su dieta después de ejercicios intensos de resistencia puede mejorar la síntesis de proteínas musculares. [20].
Es por eso que la gente suele referirse al período posterior al entrenamiento como la “ventana anabólica”.
Sin embargo, la ventana anabólica probablemente sea más larga de lo que se pensaba anteriormente, ya que los músculos parecen permanecer receptivos a las proteínas hasta 24 horas después del ejercicio. [21].
Es más fácil recordar tomar proteínas inmediatamente después de hacer ejercicio. Ofrece una ventana de oportunidad para distribuir las proteínas a lo largo del día, por lo que intentar tomar proteínas poco después de un entrenamiento puede ser beneficioso.
Consumir proteínas después del ejercicio, especialmente cuando la ingesta de carbohidratos está por debajo de los niveles óptimos (<1.2 g/kg/día), puede mejorar la recuperación del glucógeno muscular y potencialmente reducir el daño muscular post-entrenamiento. [11].
- Durante los entrenamientos

Si bien el consumo de proteínas durante los entrenamientos no ha demostrado una mejora en el rendimiento, los estudios indican que puede reducir los indicadores de daño muscular post-entrenamiento dentro de las 12 a 24 horas y aliviar el dolor muscular después del ejercicio. [22, 23, 24].
Se recomienda que los deportistas tomen unos 0.25 g de proteína por kg de peso corporal y por hora de entrenamiento. [23].
- Merienda antes de acostarse
Numerosos estudios han informado que consumir de 20 a 30 g de proteína entre 30 y 90 minutos antes de acostarse puede mejorar la síntesis de proteínas musculares sin provocar aumento de grasa. [25, 26, 27].
La cantidad diaria de proteínas (CDR) recomendada es actualmente de 0.8 g/kg/día, pero puede no ser suficiente para los deportistas. Las sugerencias anteriores de 1.2 a 1.3 g/kg/día pueden haber subestimado las necesidades.
Los requerimientos de proteínas dependen de factores como el ejercicio, la edad, la composición corporal y la ingesta de energía.
La ingesta diaria de 1.4 a 2.0 g/kg/día se considera la mínima, con cantidades más altas para quienes limitan las calorías y mantienen la masa muscular.
Las recomendaciones varían según la edad y el ejercicio de resistencia reciente para una síntesis óptima de proteínas musculares, y generalmente sugieren 0.25 g/kg o una dosis absoluta de 20 a 40 g por porción.
Las personas de mayor edad pueden beneficiarse de dosis más altas (alrededor de 40 g), y es posible que se necesiten incluso más (aproximadamente 70 g) para reducir la degradación de las proteínas musculares de manera efectiva.
- Importe total por día
Una revisión sistemática de 49 estudios demostró que 1.6 g/kg de proteína al día aumentaban eficazmente la masa muscular durante el entrenamiento de resistencia en adultos sanos. [36].
Para los atletas con un gran déficit calórico, una mayor ingesta de proteínas puede ser beneficiosa para retener la masa muscular: hasta 2.3 – 3.1 g/kg de masa libre de grasa por día. [37].
Un estudio final demostró que consumir más de 5.5 veces la dosis diaria recomendada, hasta 4 g/kg, mientras se está en exceso (ingeriendo más calorías de las que necesita cada día) no conduce a un aumento de masa grasa, lo que la convierte en una excelente estrategia. mientras construyes músculo [38].
Reparación de tendones

Colágeno
La estructura y función de tejidos como tendones, ligamentos, cartílagos y huesos dependen de su matriz rica en colágeno.
Esta matriz, que es el componente no celular de estos tejidos, está influenciada por factores como la cantidad de colágeno, el entrecruzamiento y el contenido del tejido (agua o minerales). [28, 29].
Las enfermedades o los problemas nutricionales/genéticos pueden comprometer esta matriz, haciendo que los tejidos sean menos capaces de manejar la actividad normal. [30].
La nutrición adecuada y el ejercicio generalmente mejoran la función de la matriz. El ejercicio intenso promueve la síntesis de colágeno y la expresión de una enzima crucial para la fortaleza del colágeno.
En consecuencia, después del entrenamiento, los tejidos se vuelven más densos, rígidos y fuertes, capaces de soportar cargas más elevadas. [31, 32].
En un estudio con ocho hombres sanos [17], los participantes tomaron 5 o 15 g de gelatina enriquecida con vitamina C o un placebo durante tres días.
Se recolectaron muestras de sangre para verificar los aminoácidos y se tomaron muestras más grandes antes y después de la ingesta de gelatina para tratar los ligamentos diseñados.
Luego, los participantes realizaron sesiones de saltar la cuerda de 6 minutos tres veces al día con un intervalo de 6 horas. Los resultados mostraron un aumento de aminoácidos después de la ingesta de gelatina.
Los ligamentos tratados con suero de consumidores de gelatina tenían más colágeno y mejor mecánica. Aquellos que tomaron 15 g de gelatina antes del ejercicio tuvieron el doble de marcadores de síntesis de colágeno en la sangre.
Esto sugiere que agregar gelatina al ejercicio intermitente puede aumentar la síntesis de colágeno, lo que podría ayudar con la prevención de lesiones y la reparación de tejidos.
Debido a la reticulación del colágeno, aumenta la densidad de la matriz, lo que a su vez aumenta la rigidez de los tendones y, como resultado, la transferencia de fuerza.
Por ejemplo, en un estudio de tres semanas [18], 50 atletas jóvenes sanos recibieron colágeno enriquecido con vitamina C o un placebo antes de sus sesiones de entrenamiento de fuerza.
El grupo que recibió colágeno hidrolizado y vitamina C tomó 20 gramos de colágeno y 50 miligramos de vitamina C al día, mientras que el grupo de placebo tomó maltodextrina.
Ambos grupos siguieron la misma rutina de entrenamiento de potencia muscular. Los investigadores midieron la tasa de desarrollo de fuerza (RFD) y otros indicadores de desempeño a lo largo del estudio.
Los resultados mostraron que la RFD máxima del grupo de colágeno y vitamina C volvió a los niveles iniciales, mientras que el grupo de placebo se mantuvo más bajo.
Al final del estudio, sólo el grupo de colágeno y vitamina C había recuperado completamente su RFD. El grupo de colágeno y vitamina C también mostró mejoras en medidas específicas relacionadas con el salto.
Esto sugiere que la suplementación con colágeno enriquecido con vitamina C podría ayudar con la potencia muscular y el desarrollo de la fuerza durante el entrenamiento de fuerza.
La proteína del suero
Hay menos evidencia disponible sobre el papel de la proteína de suero en la reparación de tendones específicamente.
Un estudio encontró que la proteína de suero puede mejorar el crecimiento de los tendones durante el entrenamiento de fuerza [33]. Respaldando el papel del suero, las ratas mostraron un crecimiento similar de los tendones después de 5 semanas de suplementación con leucina después de la desnutrición. [34].
Sin embargo, no está claro si esto sucede directamente en el tendón o si se debe a que los músculos se hacen más grandes y fuertes.
Lactosa, lácteos y otros alérgenos

La proteína del suero
Debido a que la proteína de suero es un subproducto del proceso de elaboración del queso, a menudo contiene lactosa. Si es intolerante a la lactosa, optar por el aislado de proteína de suero puede reducir las posibilidades de sentir molestias.
Con una pureza mínima del 90% de proteína, el ingrediente final contiene mínima o ninguna lactosa.
Si eres alérgico a la leche de vaca, es mejor evitar la proteína de suero y optar por suplementos proteicos de origen vegetal como la soja.
La proteína de suero contiene proteínas que se encuentran en la leche de vaca y las personas con alergia a la proteína de la leche pueden experimentar reacciones adversas, incluidas respuestas alérgicas.
Es esencial consultar con un profesional de la salud o un alergólogo para determinar las opciones de proteínas más adecuadas según las alergias individuales y los requisitos dietéticos.
Colágeno
El colágeno no contiene lactosa. Sin embargo, si tiene alergias, también tenga cuidado al considerar los suplementos de colágeno.
Los suplementos de colágeno a menudo se derivan de fuentes animales, como el colágeno bovino (vaca), porcino (cerdo) o marino (pez).
Las personas con alergias específicas a estas fuentes pueden experimentar reacciones alérgicas a los suplementos de colágeno.
Lea atentamente las etiquetas de los productos y elija suplementos de colágeno que indiquen explícitamente su origen.
También hay suplementos de colágeno disponibles que están etiquetados como hipoalergénicos o formulados específicamente para minimizar el potencial alergénico.
Sin embargo, las respuestas individuales a estos productos pueden variar y es recomendable buscar orientación profesional para garantizar la seguridad de los suplementos de colágeno para personas con alergias.
¿Debería utilizar colágeno o proteína de suero?
Los dos productos tienen diferentes perfiles de aminoácidos y posteriormente se utilizan por diferentes motivos. La proteína de suero es un claro ganador para desarrollar músculo y recuperarlo.
Para fortalecer los tendones y recuperarse de lesiones tisulares, el colágeno sería su mejor opción, pero es fundamental tomarlo entre 30 y 60 minutos antes del entrenamiento con una fuente de vitamina C para mejorar la eficacia.
Referencias
1. Antonio, J., Peacock, CA, Ellerbroek, A., Fromhoff, B. y Silver, T. (2014). Los efectos del consumo de una dieta alta en proteínas (4.4 g/kg/d) sobre la composición corporal en individuos entrenados en resistencia. J Int Soc Deportes Nutrición, 11, 19. doi:10.1186/1550-2783-11-19
2. Aussieker, T., Hilkens, L., Holwerda, AM, Fuchs, CJ, Houben, LHP, Senden, JM. . . LJC, VANL (2023). La ingestión de proteína de colágeno durante la recuperación del ejercicio no aumenta las tasas de síntesis de la proteína conectiva muscular. Ejercicio deportivo de ciencias médicas, 55(10), 1792-1802. doi:10.1249/mss.0000000000003214
3. Baar, K. (2017). Minimizar las lesiones y maximizar el regreso al juego: lecciones de los ligamentos diseñados. Medicina deportiva, 47(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
4. Barbosa, AW, Benevides, GP, Alferes, LM, Salomão, EM, Gomes-Marcondes, MC y Gomes, L. (2012). Una dieta rica en leucina y el ejercicio afectan las características biomecánicas del tendón flexor digital en ratas después de la recuperación nutricional. Aminoácidos, 42(1), 329-336. doi:10.1007/s00726-010-0810-1
5. Buehler, MJ (2008). Nanomecánica de fibrillas de colágeno bajo diferentes densidades de entrecruzamiento: estudios atomísticos y continuos. J Mech Behav Biomed Mater, 1(1), 59-67. doi:10.1016/j.jmbbm.2007.04.001
6. Burd, NA, West, DW, Moore, DR, Atherton, PJ, Staples, AW, Prior, T.,. . . Phillips, SM (2011). La sensibilidad mejorada a los aminoácidos de la síntesis de proteínas miofibrilares persiste hasta 24 h después del ejercicio de resistencia en hombres jóvenes. J Nutr, 141(4), 568-573. doi:10.3945/jn.110.135038
7. Churchward-Venne, T. y Burd, N. (2012). Suplementación de una dosis subóptima de proteína con leucina o EAA: efectos de la síntesis de proteínas miofibrilares en reposo y después del ejercicio de resistencia en hombres. Revista de Fisiología.
8. Coffey, VG, Moore, DR, Burd, NA, Rerecich, T., Stellingwerff, T., Garnham, AP,. . . Hawley, JA (2011). El suministro de nutrientes aumenta la señalización y la síntesis de proteínas en el músculo esquelético humano después de carreras repetidas. Eur J Appl Physiol, 111(7), 1473-1483. doi:10.1007/s00421-010-1768-0
9. Couppé, C., Kongsgaard, M., Aagaard, P., Hansen, P., Bojsen-Moller, J., Kjaer, M. y Magnusson, SP (2008). La carga habitual produce hipertrofia del tendón y aumento de la rigidez del tendón rotuliano humano. J Appl Physiol (1985), 105(3), 805-810. doi:10.1152/japplphysiol.90361.2008
10. Devries, MC, McGlory, C., Bolster, DR, Kamil, A., Rahn, M., Harkness, L.,. . . Phillips, SM (2018). El contenido de leucina, no de proteína total, de un suplemento es el principal determinante de las respuestas anabólicas de las proteínas musculares en mujeres mayores sanas. La Revista de Nutrición, 148.(7), 1088-1095.
11. Farup, J., Rahbek, SK, Vendelbo, MH, Matzon, A., Hindhede, J., Bejder, A.,. . . Vissing, K. (2014). El hidrolizado de proteína de suero aumenta la hipertrofia de tendones y músculos independientemente del modo de contracción del ejercicio de resistencia. Scand J Med Sci Deportes, 24(5), 788-798. doi:10.1111/sms.12083
12. Heinemeier, KM, Olesen, JL, Haddad, F., Schjerling, P., Baldwin, KM y Kjaer, M. (2009). Efecto de la descarga seguida de recarga sobre la expresión de colágeno y factores de crecimiento relacionados en tendones y músculos de ratas. J Appl Physiol (1985), 106(1), 178-186. doi:10.1152/japplphysiol.91092.2008
13. Helms, ER, Zinn, C., Rowlands, DS y Brown, SR (2014). Una revisión sistemática de las proteínas dietéticas durante la restricción calórica en atletas delgados entrenados en resistencia: un caso a favor de una mayor ingesta. Int J Sport Nutr Exerc Metab, 24(2), 127-138. doi:10.1123/ijsnem.2013-0054
14. Hou, Y. y Wu, G. (2018). Aminoácidos nutricionalmente esenciales. Avances en Nutrición, 9(6), 849-851.
15. Jäger, R., Kerksick, CM, Campbell, BI, Cribb, PJ, Wells, SD, Skwiat, TM,. . . Antonio, J. (2017). Puesto de Posición de la Sociedad Internacional de Nutrición Deportiva: proteínas y ejercicio. J Int Soc Deportes Nutrición, 14, 20. doi:10.1186/s12970-017-0177-8
16. Kerksick, CM, Wilborn, CD, Roberts, MD, Smith-Ryan, A., Kleiner, SM, Jäger, R.,. . . Kreider, RB (2018). Actualización de la revisión de nutrición deportiva y ejercicio del ISSN: investigación y recomendaciones. J Int Soc Deportes Nutrición, 15(1), 38. doi:10.1186/s12970-018-0242-y
17. Kerksick, CM, Wismann-Bunn, J., Fogt, D., Thomas, AR, Taylor, L., Campbell, BI,. . . Kreider, RB (2010). Cambios en la pérdida de peso, la composición corporal y el riesgo de enfermedad cardiovascular después de alterar la distribución de macronutrientes durante un programa de ejercicio regular en mujeres obesas. Nutr J, 9, 59. doi:10.1186/1475-2891-9-59
18. Khatri, M., Naughton, RJ, Clifford, T., Harper, LD y Corr, L. (2021). Los efectos de la suplementación con péptidos de colágeno sobre la composición corporal, la síntesis de colágeno y la recuperación de lesiones articulares y ejercicio: una revisión sistemática. Aminoácidos, 53(10), 1493-1506.
19. Kinsey, AW y Ormsbee, MJ (2015). El impacto en la salud de comer durante la noche: viejas y nuevas perspectivas. Nutrientes, 7(4), 2648-2662.
20. Kipp, DE, McElvain, M., Kimmel, DB, Akhter, MP, Robinson, RG y Lukert, BP (1996). El escorbuto produce una disminución de la síntesis de colágeno y de la densidad ósea en el modelo animal de cobaya. Hueso, 18(3), 281-288. doi:10.1016/8756-3282(95)00481-5
21. Kjaer, M. (2004). Papel de la matriz extracelular en la adaptación del tendón y del músculo esquelético a la carga mecánica. Fisiol Rev, 84(2), 649-698. doi:10.1152/physrev.00031.2003
22. Lis, DM, Jordan, M., Lipuma, T., Smith, T., Schaal, K. y Baar, K. (2022). La suplementación con colágeno y vitamina C aumenta la tasa de desarrollo de fuerza de las extremidades inferiores. Int J Sport Nutr Exerc Metab, 32(2), 65-73. doi:10.1123/ijsnem.2020-0313
23. Liu, D., Nikoo, M., Boran, G., Zhou, P. y Regenstein, JM (2015). Colágeno y gelatina. Annu Rev Food Sci Technol, 6, 527-557. doi:10.1146/annurev-food-031414-111800
24. Oertzen-Hagemann, V., Kirmse, M., Eggers, B., Pfeiffer, K., Marcus, K., de Marées, M. y Platen, P. (2019). Efectos de 12 semanas de entrenamiento con ejercicios de resistencia a la hipertrofia combinados con suplementos de péptidos de colágeno sobre el proteoma del músculo esquelético en hombres recreativamente activos. Nutrientes, 11(5). doi:10.3390/nu11051072
25. Oikawa, SY, Kamal, MJ, Webb, EK, McGlory, C., Baker, SK y Phillips, SM (2020). La proteína de suero, pero no los péptidos de colágeno, estimulan la síntesis de proteínas musculares aguda y a largo plazo con y sin ejercicio de resistencia en mujeres mayores sanas: un ensayo controlado aleatorio. Soy J Clin Nutr, 111(3), 708-718. doi:10.1093/ajcn/nqz332
26. Ricard-Blum, S. (2011). La familia del colágeno. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
27. Romano-Ely, BC, Todd, MK, Saunders, MJ y LAURENT, TS (2006). Efecto de una bebida isocalórica de carbohidratos, proteínas y antioxidantes sobre el rendimiento en bicicleta. Medicina y ciencia en deportes y ejercicio, 38(9), 1608-1616.
28. Saunders, MJ, Kane, MD y Todd, MK (2004). Efectos de una bebida de carbohidratos y proteínas sobre la resistencia en bicicleta y el daño muscular. Medicina y ciencia en deportes y ejercicio, 36(7), 1233-1238.
29. Shaw, G., Lee-Barthel, A., Ross, ML, Wang, B. y Baar, K. (2017). La suplementación con gelatina enriquecida con vitamina C antes de la actividad intermitente aumenta la síntesis de colágeno. Soy J Clin Nutr, 105(1), 136-143. doi:10.3945/ajcn.116.138594
30. Hombros, MD y Raines, RT (2009). Estructura y estabilidad del colágeno. Annu Rev Bioquímica, 78, 929-958. doi:10.1146/annurev.biochem.77.032207.120833
31. Solah, VA, Kerr, DA, Adikara, CD, Meng, X., Binns, CW, Zhu, K.,. . . Príncipe, RL (2010). Diferencias en los efectos de saciedad de los alimentos a base de alginato y proteína de suero. Apetito, xnumx(3), 485-491. doi:10.1016/j.appet.2010.01.019
32. Tang, JE, Moore, DR, Kujbida, GW, Tarnopolsky, MA y Phillips, SM (2009). Ingestión de hidrolizado de suero, caseína o aislado de proteína de soja: efectos sobre la síntesis de proteínas musculares mixtas en reposo y después de ejercicios de resistencia en hombres jóvenes. Revista de fisiología aplicada.
33. Trommelen, J. y Van Loon, LJ (2016). Ingesta de proteínas antes del sueño para mejorar la respuesta adaptativa del músculo esquelético al entrenamiento físico. Nutrientes, 8(12), 763.
34. Valentine, RJ, Saunders, MJ, Todd, MK y Laurent, TGS (2008). Influencia de las bebidas con carbohidratos y proteínas sobre la resistencia en bicicleta y los índices de alteración muscular. Revista internacional de nutrición deportiva y metabolismo del ejercicio, 18(4), 363-378.
35. van der Rest, M. y Garrone, R. (1991). Familia de proteínas del colágeno. Faseb j, 5(13), 2814-2823.
36. Xu, R., Liu, N., Xu, X. y Kong, B. (2011). Efectos antioxidantes de la proteína de suero sobre la citotoxicidad inducida por peróxido. J Ciencias Lácteas, 94(8), 3739-3746. doi:10.3168/jds.2010-3891
37. Zhou, N., Liu, Y.-D., Zhang, Y., Gu, T.-W. y Peng, L.-H. (2023). Funciones farmacológicas, síntesis y progreso en la administración del colágeno como biofármaco y biomaterial. Farmacéutica, 15(5), 1443. Obtenido de https://www.mdpi.com/1999-4923/15/5/1443
