El colágeno es una proteína que puede ayudar con el dolor en las articulaciones y la recuperación de los tejidos blandos. Sin embargo, existen muchos suplementos en el mercado, y seguramente habrás notado diferentes tipos de colágeno, por ejemplo, colágeno I, II, II, IV… y así sucesivamente.
Aunque los diferentes tipos de colágeno tienen funciones distintas y esenciales en el cuerpo, no es necesario tomar suplementos separados para desarrollar estos colágenos, ya que todos están compuestos por los mismos aminoácidos: glicina, prolina e hidroxiprolina. Siempre que obtenga una cantidad suficiente de estos aminoácidos en el momento adecuado (60 a 90 minutos antes de un entrenamiento) con una fuente de vitamina C, su cuerpo puede producir los diferentes tipos de colágeno que necesita.
Sin embargo, es bueno comprender qué hacen los diferentes tipos de colágeno en el cuerpo, por qué es necesario ingerir suficiente colágeno y cómo interpretar las diferentes etiquetas de los suplementos.
Índice del contenido
¿Qué es el colágeno?
El colágeno es una parte vital de la estructura de los tejidos que les da flexibilidad. En los músculos, el tejido conectivo ayuda a transmitir la fuerza de las contracciones musculares a los tendones y huesos.
Las proteínas del tejido conectivo cambian constantemente y pueden adaptarse. Comer proteínas aumenta la síntesis de proteínas musculares.
Por lo general, se recomiendan proteínas de alta calidad y fáciles de digerir para obtener mejores resultados. Curiosamente, estudios recientes muestran que la ingesta de proteínas no aumenta la producción de proteínas en el tejido conectivo muscular.
Esta falta de aumento podría deberse a una cantidad insuficiente de glicina y/o prolina. Se sugiere que los alimentos ricos en colágeno que contienen mucha glicina y prolina proporcionen los componentes básicos para la síntesis de proteínas del tejido conectivo. [1].
En el cuerpo, el colágeno es como el andamio que mantiene todo unido. Imagínelo como el componente esencial que mantiene la salud de nuestra piel y tejidos conectivos. [2].
El “tejido conectivo” es el marco de soporte que une nuestros órganos y tejidos. Está compuesto por fibroblastos y su matriz extracelular, una especie de andamio que rodea las células.
Esta matriz extracelular es vital porque garantiza que las células se unan, mantiene la estabilidad y ayuda en el proceso de regeneración en diferentes tejidos. [3].
Estos tejidos necesitan colágeno para mantenerse fuertes, flexibles y capaces de repararse a sí mismos. El colágeno forma parte de la matriz extracelular, que es como una red de soporte para nuestras células. [4].
Esta matriz proporciona estructura y ayuda a regular y renovar nuestros tejidos.
Piense en los tendones, las bandas resistentes que conectan los músculos con los huesos. Dependen en gran medida del colágeno, que constituye una parte importante de su peso.
La estructura única del colágeno, formada por aminoácidos específicos como la glicina y la prolina, le da fuerza. Esto es particularmente importante para que los tendones resistan tensiones y fuerzas, como las que se encuentran durante las actividades deportivas, lo que ayuda a mantenerlos sanos y reduce el riesgo de lesiones. [5].
Entonces, el colágeno no es sólo una proteína; es un elemento crucial que mantiene bajo control la integridad estructural de nuestro cuerpo.
El colágeno forma una “triple hélice” que le ayuda a ser fuerte y flexible. La triple hélice consta de tres cadenas polipeptídicas, o hebras de proteínas, entrelazadas como una cuerda.
Estas cadenas son ricas en aminoácidos, siendo la glicina la más abundante. La prolina y la hidroxiprolina también son cruciales para estabilizar la estructura. [2, 6].
Esta combinación de fuerza y flexibilidad hace que el colágeno sea muy adecuado para brindar soporte estructural en tejidos como la piel, los tendones y los huesos.
¿Debería tomar un tipo de colágeno específico?

El colágeno tipo I predomina en los huesos, músculos y tejido conectivo. Aún no hay suficientes investigaciones para decir que consumir colágeno tipo I es superior a consumir otros tipos de colágeno, como el tipo II o III, porque todos contienen componentes básicos similares, es decir, aminoácidos.
Curiosamente, muchos estudios también utilizan la gelatina como fuente de colágeno al estudiar el impacto del colágeno en el cuerpo.
Una vez más, enfatizamos que la principal prioridad es obtener los diferentes aminoácidos que pueden formar los distintos tipos de colágeno.
Sin embargo, debido a que el colágeno tipo I desempeña un papel tan importante en los huesos, los músculos y los tejidos conectivos, tiene sentido optar por él al elegir un suplemento de colágeno.
Diferentes tipos de colágeno
Existen un total de 29, cada uno designado con números romanos I-XXIX en orden de descubrimiento. [7, 8]. Cada tipo de colágeno tiene características, funciones y ubicaciones únicas dentro del cuerpo. [2].
Los diferentes tipos de colágeno tienen diferencias estructurales que les ayudan a tener diferentes funciones corporales en diferentes lugares.
Su composición y disposición de aminoácidos determinan la estructura física del colágeno y cómo interactúan las moléculas de colágeno individuales para formar estructuras más grandes. [2, 5, 9].
Así es como se relaciona la estructura física con la diversidad de tipos de colágeno:
- Composición de aminoácidos:
La composición de aminoácidos del colágeno varía entre los diferentes tipos. Por ejemplo, los tipos de colágeno I y II tienen un alto contenido de glicina, prolina e hidroxiprolina, mientras que otros tipos pueden tener diferentes composiciones de aminoácidos. Esta variación influye en la fuerza, flexibilidad y estabilidad de la estructura del colágeno. [9].
- Estructura de triple hélice:
La "triple hélice" se refiere a cómo se forma el colágeno. Cada estructura consta de tres cadenas polipeptídicas enrolladas entre sí, casi como una cuerda.
Cada una de estas cadenas se conoce como alfa cadena (recuerda esto porque nos referiremos a ello más adelante en este post). El tipo específico de colágeno está determinado por la disposición de estas cadenas alfa y las características de la estructura de colágeno resultante.
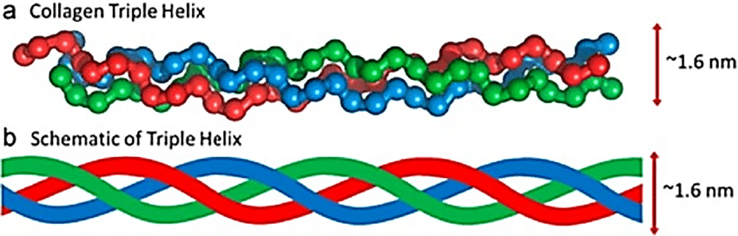
Figura 1: La estructura de triple hélice del colágeno. [10]
- Formación de fibrillas:
Las moléculas de colágeno se ensamblan en estructuras más grandes, como fibrillas y fibras. [2, 9].
Las “fibrillas” se refieren a estructuras diminutas en forma de hilos, más pequeñas que las fibras pero más grandes que las moléculas individuales. Imagínelos como hilos o hebras en miniatura que forman una estructura más grande. En el contexto del colágeno, las fibrillas son los componentes básicos de las fibras de colágeno.
Imagínese una cuerda hecha de muchos hilos pequeños entrelazados. Cada uno de estos hilos se puede comparar con una fibrilla.
Estas fibrillas unen fuerzas para crear una estructura más significativa y fuerte, similar a cómo los hilos de una cuerda se combinan para formar una cuerda robusta y duradera.
La forma en que se forman estas estructuras y las interacciones entre las moléculas de colágeno influyen en las propiedades físicas de los tejidos.
- Reticulación:
Las fibras de colágeno se estabilizan mediante enlaces químicos entrecruzados entre moléculas de colágeno adyacentes. El patrón y el grado de reticulación contribuyen a la fuerza y resistencia de los tejidos ricos en colágeno, como se ve en la Figura 2.
Los diferentes tipos de colágeno pueden presentar variaciones en los patrones de entrecruzamiento, lo que afecta las características físicas de los tejidos. [11].
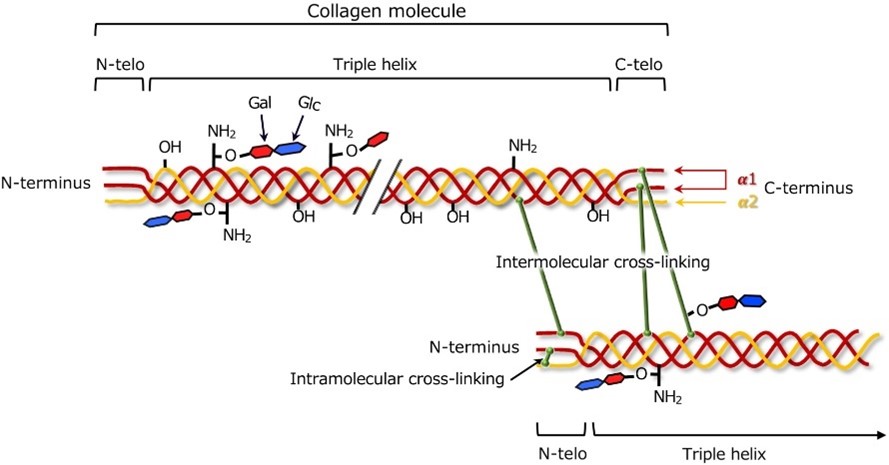
Figura 2: Reticulación de colágeno [12]
Según cómo se configuran en los tejidos, los colágenos son genéticamente diferentes y se clasifican en subgrupos. [13].
Los colágenos como I, II, III, V y X se unen para crear grandes fibrillas fuera de las células, lo que les valió el nombre de colágenos formadores de fibrillas.
El colágeno tipo IV, por otro lado, forma una red entrecruzada en las membranas basales. Luego está el colágeno tipo VI, que produce microfibrillas únicas, y el colágeno tipo VII, que crea fibrillas de anclaje.
Un grupo llamado colágenos FACIT [14] (colágenos asociados a fibrillas con triples hélices interrumpidas), incluidos los tipos IX, XII, XIV, XIX, XX y XXI, se asocian con las fibras de colágeno más grandes, actuando como puentes moleculares.
Su trabajo es mantener la matriz extracelular organizada y estable. Es como si fueran el equipo de soporte que garantiza que todo permanezca en su lugar.
Tipo I

El colágeno tipo I es un componente fundamental que se encuentra en nuestros huesos, piel y tejidos conectivos. [15]. No sólo es el tipo de colágeno más abundante sino que también juega un papel vital en el mantenimiento de la estructura y fuerza de estos tejidos.
Piense en él como el arquitecto principal, que forma la estructura básica de varias partes de nuestro cuerpo. Los científicos han estudiado ampliamente el colágeno tipo I debido a su importancia, lo que lo convierte en el tipo de colágeno más investigado.
Es un componente fundamental en casi todos los tejidos conectivos, formando la estructura primaria de la membrana intersticial que sostiene y mantiene unido nuestro cuerpo.
Más allá de su importancia estructural, El colágeno tipo I encuentra aplicaciones en diversos escenarios médicos, incluidos procedimientos quirúrgicos, curación de heridas e ingeniería de tejidos. [16], mostrando su versatilidad e importancia en la promoción de la salud y la recuperación.
Tipo II
Déjame desglosarlo por ti: El colágeno tipo II es el ingrediente principal en la estructura del cartílago., que es el material que amortigua y sostiene tus articulaciones.
Aproximadamente el 90% del colágeno del cartílago es colágeno tipo II. [17].
Las características únicas del colágeno tipo II lo hacen esencial para la resiliencia y las propiedades de absorción de impactos del cartílago, lo cual es crucial para la salud de las articulaciones.
El colágeno tipo 2 crea una red de pequeñas fibras necesarias para la resistencia del cartílago. [18, 19].
El colágeno tipo II también tiene un papel importante en el crecimiento y cambios de las células (llamadas condrocitos) en el desarrollo normal del cartílago y cuando alguien tiene osteoartritis (OA), una condición que afecta las articulaciones.
Cuando se pierde colágeno tipo II, se puede acelerar el crecimiento de los condrocitos y la progresión de la osteoartritis.
Ocurre a través de algo llamado vía BMP-SMAD1, que es como un sistema de comunicación dentro de las células.
Entonces, en pocas palabras, tener suficiente colágeno tipo II es esencial para mantener el cartílago sano y evitar que la osteoartritis empeore. [20].
Un estudio realizado en 2016 demostró que el uso conjunto de colágeno nativo tipo II y paracetamol (un tipo de medicamento utilizado para tratar la osteoartritis) funciona mejor para aliviar los síntomas en personas con osteoartritis de rodilla que usar solo paracetamol.
Por lo tanto, combinar estos dos tratamientos parece ser más eficaz para ayudar a los pacientes a controlar los síntomas de la osteoartritis de rodilla. [21].
Tipo III

Descubierto en 1971, el colágeno tipo III es un actor importante en la familia del colágeno y constituye entre el 5 y el 20 % del contenido total de colágeno de nuestro cuerpo. Es como un componente fundamental que contribuye a la integridad estructural. [22].
El colágeno tipo III también se denomina cadena alfa-1 (III) de colágeno o cadena alfa 1 del colágeno tipo III. [23] (recuerde que mencionamos que las cadenas alfa son las “cuerdas” individuales que forman la estructura de triple hélice del colágeno).
El colágeno tipo III es una proteína codificada por el gen COL3A1 en humanos (esto significa que el gen le indica al cuerpo que produzca colágeno tipo III) [23].
Se encuentra en cantidades significativas en los grandes vasos sanguíneos, el útero y el intestino y sirve como componente estructural, esencialmente proporcionando un andamio para estos órganos huecos.
Pero su importancia va más allá de la estructura. Se relaciona con las plaquetas de la sangre, ayudando en el proceso de coagulación y también actúa como molécula de señalización durante la cicatrización de heridas.
La importancia del colágeno tipo III se vuelve aún más clara cuando se estudian individuos con mutaciones en el gen COL3A1.
Estas mutaciones pueden provocar problemas graves, como roturas espontáneas en las arterias, el útero y el intestino (el intestino).
Esto resalta el papel indispensable del colágeno tipo III para mantener estos órganos estructuralmente intactos. [24, 25, 26].
Curiosamente, las mutaciones en el gen COL3A1 también pueden provocar anomalías cerebrales graves. Esto sugiere que el colágeno tipo III no se trata sólo de estructura física.
También es fundamental para el desarrollo normal del cerebro. [27, 28, 29].
Entonces, más allá de ser una potencia estructural, el colágeno tipo III desempeña funciones vitales en todo nuestro cuerpo, influyendo tanto en la estructura física como en los procesos funcionales.
Tipo IV
El colágeno tipo IV es una proteína que se distribuye en múltiples tejidos, especialmente en un área llamada membrana basal.
Se puede encontrar en varios lugares del cuerpo, como el cabello, las superficies celulares y la placenta. [30].
Lo que hace que el colágeno tipo IV sea interesante es su estructura. Al final de su cadena (extremo C), hay algo llamado dominio C4 y, a diferencia de otros colágenos, no se elimina durante el proceso de producción de proteínas.
Esta característica única hace que las fibras de colágeno se unan cabeza con cabeza en lugar de una al lado de la otra. [30].
El colágeno tipo IV no tiene un aminoácido específico (glicina) en una de cada tres posiciones de su cadena, lo cual es típico en otros tipos de colágeno.
Esta ausencia hace que el colágeno tipo IV sea más flexible y curvado en su forma general que otras variedades de colágeno. [31].
Debido a estas características estructurales, el colágeno tipo IV tiene una capacidad especial: puede formar láminas. Estas láminas son una parte importante de la composición estructural de la membrana basal de la piel.
Esto significa que el colágeno tipo IV tiene una estructura distinta que le permite crear láminas curvas y flexibles, y descubrirá que desempeña un papel clave en la estructura de la membrana basal de la piel. [32, 33].
Tipo V
El colágeno tipo V es como un colágeno “administrador” que ayuda a regular la formación de fibrillas (que son como hilos de colágeno).
Viene en al menos tres versiones diferentes: α1(V)2 α2(V), α1(V)3 y α1(V)α2(V)α3(V). Estas versiones se crean combinando tres cadenas alfa diferentes: α1(V), α2(V) y α3(V). [34].
El colágeno tipo V no es el personaje principal en la historia de la matriz extracelular; Es más como un actor secundario. Se enlaza con otros colágenos como el colágeno tipo I, formando estas fibrillas mixtas o hilos finos con características distintas. [35].
Las células de varias partes de nuestro cuerpo producen colágeno tipo V, y su producción está influenciada por elementos como el TGF-β (factor de crecimiento transformante beta) y otros factores de crecimiento. [36].
Aunque puede resistir la digestión por ciertas enzimas. [37], no es invencible: las metaloproteinasas y gelatinasas (ciertas enzimas del cuerpo) pueden descomponerlo, ayudando en la remodelación (construcción) de la matriz extracelular. [38].
El colágeno tipo V es como un jugador de equipo. Interactúa con otros tipos de colágeno y proteínas estructurales, fortaleciendo el andamio de nuestros tejidos.
También interactúa con macromoléculas de la matriz, influyendo en cómo se comportan y funcionan las células en nuestro cuerpo. [37]. El colágeno tipo V juega un papel crucial en el mantenimiento de la estructura y función de nuestros tejidos.
Tipo VI
El colágeno VI desempeña varias funciones en los tejidos donde se encuentra, llevando a cabo funciones mecánicas, protegiendo las células inhibiendo la apoptosis (muerte celular programada) y protegiendo contra el daño oxidativo.
También contribuye al desarrollo y progresión del tumor al influir en la diferenciación celular y los mecanismos autofágicos. [39].
Este tipo de colágeno desempeña un papel en el anclaje de células y tejidos, contribuyendo a la estabilidad general de la matriz extracelular.
Tipo VII
El colágeno tipo VII recibió su nombre porque, al principio, la gente pensaba que era una molécula extralarga, por lo que lo llamaron colágeno de cadena larga.
Este colágeno es importante en la formación de fibrillas de anclaje, que son como vigas de soporte que brindan estabilidad a la forma en que la capa externa de la piel (epidermis) se adhiere a la capa más profunda (dermis) en una interfaz específica llamada lámina lúcida/dermis papilar [40].
Tipo VIII
El colágeno tipo VIII es producido por varios tipos de células, incluidas las células endoteliales (las que recubren los vasos sanguíneos), los queratinocitos (células de la capa externa de la piel), los mastocitos (un tipo de célula inmunitaria), las células endoteliales microvasculares (pequeños vasos sanguíneos). , e incluso algunas células tumorales.
Puedes encontrarlo en diferentes matrices extracelulares, como en la parte blanca del ojo (esclerótica), la piel y los pequeños filtros de los riñones (glomérulo) [6, 41].
En cuanto a su estructura, el colágeno tipo VIII está formado por dos cadenas alfa, específicamente, [alfa 1(VIII)2 alfa 2(VIII)] [42].
Aún se desconoce su papel en el organismo, aunque estudios recientes sugieren que es relativamente importante en los vasos sanguíneos.
Algunas investigaciones indican que puede desempeñar un papel en el movimiento de las células del músculo liso, que es fundamental para mantener la estructura de los vasos sanguíneos.
Los investigadores especulan que el colágeno tipo VIII podría actuar como una especie de base para varias células, ayudando a las células endoteliales a moverse durante la formación de nuevos vasos sanguíneos (angiogénesis), ayudando a las células del músculo liso a penetrar la capa interna de los vasos sanguíneos (invasión de la íntima) y ayudar a los miofibroblastos durante la cicatrización del tejido (condiciones fibróticas) [43].
Tipo X
El colágeno tipo X es un miembro especial de la familia del colágeno de cadena corta, que se encuentra principalmente en el cartílago y es crucial para el crecimiento y desarrollo de los huesos.
Se encuentra principalmente en las placas de crecimiento de los huesos, donde se produce la formación de hueso nuevo durante el desarrollo y el crecimiento.
La función principal del colágeno tipo X es contribuir al desarrollo y la mineralización de los huesos, particularmente en las placas de crecimiento.
Es como un marcador para un tipo específico de célula de cartílago maduro llamado "condrocitos hipertróficos". [44]. En los seres humanos, hasta el 18% de la síntesis de colágeno en determinadas regiones puede ser de tipo X.
Se cree que su función ayuda en el proceso de calcificación, influyendo potencialmente en la organización de la matriz del cartílago.
Los investigadores creen que el colágeno tipo X es vital para comprender el crecimiento y la diferenciación de los condrocitos. Las mutaciones en este tipo de colágeno podrían estar relacionadas con ciertos trastornos del desarrollo óseo [45].
En general, el colágeno tipo X proporciona una perspectiva de la biología del cartílago, lo que ayuda a los investigadores a aprender más sobre el crecimiento y desarrollo de los huesos.
Tipo XI
El colágeno tipo XI desempeña un papel en la estructura estructural del cuerpo.
Actuando como colágeno fibrilar, está muy extendido en diversos tejidos como el cartílago articular, los testículos, los tendones, los huesos, los músculos, la placenta, los pulmones e incluso el neoepitelio del cerebro.
Su trabajo es regular la fibrilogénesis, lo que ayuda a formar fibrillas de colágeno, esas estructuras en forma de hilos que mantienen unidos nuestros tejidos. [46].
Una de sus funciones es mantener la separación y el diámetro de las fibrillas de colágeno tipo II, actuando como supervisor de su correcta formación. También desempeña un papel en el impulso de la formación de colágeno tipos I y II. [46].
Puede unirse con sustancias como heparina, heparán sulfato y dermatán sulfato. Sin embargo, a pesar de su potencial importancia, actualmente carecemos de biomarcadores específicos para medir el colágeno tipo XI. [47].
Tipos XII, XIV y XVI
El colágeno tipo XII es como el supervisor en ciertas partes de nuestro cuerpo: se encuentra principalmente en el pericondrio (una capa alrededor del cartílago) y en la superficie articular.
Es una molécula “homotrimérica”, lo que significa que consta de tres partes idénticas. Imagínelo como una gran estructura en forma de cruz con dominios específicos que alcanzan el espacio alrededor de las fibrillas de colágeno.
Este colágeno tiene dos formas: uno más pequeño que se encuentra en la piel y demás y uno más grande que se encuentra en las células epidérmicas. [48].
Ahora, hablemos del colágeno tipo XIV. Es similar pero con una estructura más pequeña en forma de cruz. El colágeno tipo XIV se distribuye de manera más uniforme en varios tejidos e interactúa con el colágeno tipo I en lugares como la piel, los tendones y más. No se une directamente al colágeno tipo I sino a una sustancia llamada decorina. [48].
Por último, tenemos el colágeno tipo XVI, sintetizado por fibroblastos y mioblastos. Es parte del espectáculo en la matriz territorial de los condrocitos, esas células del cartílago.
Imagínelo como este jugador integrado en finas fibrillas de colágeno, que se juntan con el colágeno de tipos II y XI.
Es como un equipo detrás de escena en diferentes partes de nuestro cuerpo, asegurándose de que todo esté estructurado correctamente. [48].
¿Necesita todo tipo de colágeno?

Para producir colágeno en el cuerpo, es necesario tener los componentes básicos del colágeno: Los aminoácidos incluyen glicina, prolina, lisina, hidroxilisina e hidroxiprolina. [49].
Además, necesitas vitamina C para ayudar a formar colágeno en el cuerpo. La vitamina C es importante para los tejidos conectivos porque permite que una enzima llamada prolil 4-hidroxilasa haga su trabajo.
Esta enzima es necesaria para cambiar la prolina, un componente básico de las proteínas, y ayuda a producir y liberar procolágeno.
No es necesario ingerir todos los tipos de colágeno, siempre y cuando ingiera una cantidad suficiente de los componentes básicos (es decir, aminoácidos) de los que está hecho el colágeno.
Los suplementos de colágeno, e incluso la gelatina, se descomponen en glicina, prolina, lisina, hidroxilisina e hidroxiprolina y pueden usarse para producir los distintos tipos de colágeno en el cuerpo.
¿Importa la fuente de colágeno?
La proteína de colágeno de origen animal puede no ser adecuada para atletas vegetarianos o veganos.
Si bien existen productos veganos y vegetarianos diseñados para replicar el colágeno de origen animal si se demuestra que los péptidos exclusivos de las proteínas animales poseen una actividad biológica distinta, las alternativas vegetarianas y veganas podrían considerarse menos eficientes.
Se necesitan más investigaciones para evaluar la disponibilidad de aminoácidos y la eficacia de los sustitutos del colágeno vegano.
Varias fuentes de colágeno de origen animal exhiben ligeras variaciones en su contenido de aminoácidos, pero las diferencias no son lo suficientemente significativas como para declarar que un tipo es superior a otro.
Tabla 1: Composición de aminoácidos de los cinco principales colágenos y gelatinas de mamíferos [50]
| Aminoácidos | gelatina animal | |||||||
| piel de buey | Hueso comercial | Piel de cerdo | Hueso de buey | Piel de tiburon | Piel de pez pulmonado | Hueso | Tendón | |
| Glicina | 27.5 | 27.2 | 26.4 | 25.3 | 26.5 | 24 | 25.8 | 25.4 |
| La leucina | 3.3 | 3.5 | 3.3 | 3.9 | 3.5 | 2.8 | 3.6 | 3.6 |
| prolina | 16.4 | 15.5 | 16.2 | 14.7 | 13.9 | 15.8 | 15.3 | 15.2 |
| hidroxiprolina | 14.1 | 13.3 | 13.5 | 14.1 | 10.9 | 10.8 | 14.1 | 12.6 |
| hidroxilisina | 1.0 | 0.7 | 1.0 | 1.1 | 0.8 | 1.1 | 0.6 | |
El mejor tipo de colágeno
El debate sobre la superioridad de los tipos de colágeno sigue sin resolverse debido a sus perfiles de aminoácidos similares. El colágeno tipo I surge como una opción estratégica dado su papel crucial en el refuerzo de huesos, músculos y tejidos conectivos.
La atención debe centrarse en una ingesta amplia de aminoácidos para el apoyo general del colágeno. Pero para obtener beneficios específicos, inclinarse por el colágeno tipo I podría ser su mejor opción.
Referencias
- Abreu-Vélez, AM y Howard, MS (2012). Colágeno IV en Piel Normal y en Procesos Patológicos. N Am J Medicina Ciencias, 4(1), 1-8. doi:10.4103/1947-2714.92892
- Adam, MP, Feldman, J., Mirzaa, GM, Pagon, RA, Wallace, SE, Bean, LJ. . . Amemiya, A. (1993). GeneReviews®[Internet].
- Alcaide-Ruggiero, L., Molina-Hernández, V., Granados, MM y Domínguez, JM (2021). Tipos principales y menores de colágenos en el cartílago articular: el papel de los colágenos en la evaluación del tejido reparador en defectos condrales. Int J. Mol Sci, 22(24). doi:10.3390/ijms222413329
- Aycock, RS y Seyer, JM (1989). Colágenos del hígado humano normal y cirrótico. Investigación del tejido conectivo, 23(1), 19-31.
- Baar, K. (2017). Minimizar las lesiones y maximizar el regreso al juego: lecciones de los ligamentos diseñados. Medicina deportiva, 47(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
- Bakilan, F., Armagan, O., Ozgen, M., Tascioglu, F., Bolluk, O. y Alatas, O. (2016). Efectos del tratamiento con colágeno nativo tipo II en la osteoartritis de rodilla: un ensayo controlado aleatorio. J Med euroasiático, 48 años.(2), 95-101. doi:10.5152/eurasianjmed.2015.15030
- Birk, DE (2001). Colágeno tipo V: interacciones heterotípicas de colágeno tipo I/V en la regulación del ensamblaje de fibrillas. Micras, 32(3), 223-237.
- Byers, PH, Belmont, J., Black, J., De Backer, J., Frank, M., Jeunemaitre, X.,. . . Lijadoras, L. (2017). Diagnóstico, historia natural y tratamiento del síndrome vascular de Ehlers-Danlos. Artículo presentado en el American Journal of Medical Genetics Parte C: Seminarios de Genética Médica.
- Cao, Q., Mak, KM y Lieber, CS (2002). DLPC disminuye el ARNm de colágeno inducido por TGF-β1 al inhibir p38 MAPK en células estrelladas hepáticas. Revista Estadounidense de Fisiología: Fisiología gastrointestinal y hepática, 283(5), G1051-G1061.
- Chung, HJ y Uitto, J. (2010). Colágeno tipo VII: la proteína de anclaje de las fibrillas responsable de la epidermólisis ampollosa distrófica. Clínica Dermatol, 28(1), 93-105. doi:10.1016/j.det.2009.10.011
- Clifford, T., Ventress, M., Allerton, DM, Stansfield, S., Tang, JCY, Fraser, WD. . . Stevenson, E. (2019). Los efectos de los péptidos de colágeno sobre el daño muscular, la inflamación y el recambio óseo después del ejercicio: un ensayo controlado y aleatorizado. Aminoácidos, 51(4), 691-704. doi:10.1007/s00726-019-02706-5
- Di Martino, A., Cescon, M., D'Agostino, C., Schilardi, F., Sabatelli, P., Merlini, L. y Faldini, C. (2023). Colágeno VI en el Sistema Musculoesquelético. Int J. Mol Sci, 24(6). doi:10.3390/ijms24065095
- Dong, C. y Lv, Y. (2016). Aplicación de andamio de colágeno en ingeniería de tejidos: avances recientes y nuevas perspectivas. Polímeros (Basilea), 8(2). doi:10.3390/polym8020042
- Ellingson, AJ, Pancheri, NM y Schiele, NR (2022). Reguladores de la reticulación del colágeno en tendones en desarrollo y adultos. Eur Cell Mater, 43, 130-152. doi:10.22203/eCM.v043a11
- Frantz, C., Stewart, KM y Weaver, VM (2010). La matriz extracelular de un vistazo. Ciencia de células J, 123(Parte 24), 4195-4200. doi:10.1242/jcs.023820
- Hasegawa, H., Naito, I., Nakano, K., Momota, R., Nishida, K., Taguchi, T.,. . . Ohtsuka, A. (2007). Las distribuciones de las cadenas α de colágeno tipo IV en las membranas basales de la epidermis humana y los apéndices de la piel. Archivos de histología y citología, 70.(4), 255-265.
- Holwerda, AM y van Loon, LJC (2022). El impacto de la ingesta de proteínas de colágeno en la remodelación del tejido conectivo musculoesquelético: una revisión narrativa. Nutri Rev, 80(6), 1497-1514. doi:10.1093/nutrit/nuab083
- Horn, D., Siebert, E., Seidel, U., Rost, I., Mayer, K., Abou Jamra, R.,. . . Kornak, U. (2017). Las mutaciones bialélicas COL3A1 dan como resultado un espectro clínico de anomalías cerebrales estructurales específicas y anomalías del tejido conectivo. Revista estadounidense de genética médica Parte A, 173(9), 2534-2538.
- Jørgensen, A., Fagerheim, T., Rand-Hendriksen, S., Lunde, PI, Vorren, TO, Pepin, MG,. . . Byers, PH (2015). Síndrome vascular de Ehlers-Danlos en hermanos con variantes de secuencia bialélica COL3A1 y marcada variabilidad clínica en la familia extensa. Revista Europea de Genética Humana, 23(6), 796-802.
- Kannus, P. (2000). Estructura del tejido conectivo del tendón. Scand J Med Sci Deportes, 10(6), 312-320. doi:10.1034/j.1600-0838.2000.010006312.x
- Kapandji, I. (1977). La fisiología de las articulaciones. Churchill Livingstone, 2, 186-189.
- Khoshnoodi, J., Pedchenko, V. y Hudson, BG (2008). Colágeno de mamífero IV. Microsc Res Tech, 71(5), 357-370. doi:10.1002/jemt.20564
- Konomi, H., Hayashi, T., Nakayasu, K. y Arima, M. (1984). Localización de colágeno tipo V y colágeno tipo IV en córnea, pulmón y piel humana. Evidencia inmunohistoquímica mediante anticuerpos anticolágeno caracterizados por inmunoelectrotransferencia. La revista americana de patología, 116.(3), 417.
- Kuivaniemi, H. y Tromp, G. (2019). Colágeno tipo III (COL3A1): estructura de genes y proteínas, distribución tisular y enfermedades asociadas. gen, 707, 151-171. doi:10.1016/j.gene.2019.05.003
- Lian, C., Wang, X., Qiu, X., Wu, Z., Gao, B., Liu, L.,. . . Peng, Y. (2019). El colágeno tipo II suprime la hipertrofia de los condrocitos articulares y la progresión de la osteoartritis al promover la interacción de la integrina β1-SMAD1. Investigación ósea, 7(1), 8.
- Luo, YY y Karsdal, MA (2016). Capítulo 11 – Colágeno tipo XI. En MA Karsdal (Ed.), Bioquímica de Colágenos, Lamininas y Elastina. (págs. 77-80): Prensa académica.
- Mak, KM, Png, CY y Lee, DJ (2016). Colágeno tipo V en la salud, la enfermedad y la fibrosis. Anat Rec (Hoboken), 299(5), 613-629. doi:10.1002/ar.23330
- Malfait, F., Francomano, C., Byers, P., Belmont, J., Berglund, B., Black, J.,. . . Madrigueras, NP (2017). La clasificación internacional de 2017 de los síndromes de Ehlers-Danlos. Artículo presentado en el American Journal of Medical Genetics Parte C: Seminarios de Genética Médica.
- Miller, EJ, Epstein Jr, EH y Piez, KA (1971). Identificación de tres colágenos genéticamente distintos mediante la escisión con bromuro de cianógeno de colágeno insoluble de piel y cartílago humanos. Comunicaciones de investigación bioquímica y biofísica, 42(6), 1024-1029.
- Moriya, K., Bae, E., Honda, K., Sakai, K., Sakaguchi, T., Tsujimoto, I.,. . . Sakai, T. (2011). Un mecanismo de fibrilogénesis de colágeno independiente de fibronectina en la remodelación del hígado en adultos. Gastroenterología, 140(5), 1653-1663.
- Muragaki, Y., Jacenko, O., Apte, S., Mattei, M., Ninomiya, Y. y Olsen, BR (1991). El gen del colágeno alfa 2 (VIII). Un nuevo miembro de la familia del colágeno de cadena corta ubicado en el cromosoma 1 humano. Revista de Química Biológica, 266(12), 7721-7727.
- Myllyharju, J. y Kivirikko, KI (2004). Colágenos, enzimas modificadoras y sus mutaciones en humanos, moscas y gusanos. TENDENCIAS en Genética, 20(1), 33-43.
- No, HD, Swoboda, B., Birk, DE y Kirsch, T. (2001). Procolágeno tipo IIA: expresión en el desarrollo de cartílago de extremidades de pollo y cartílago articular osteoartrítico humano. Dinámica del desarrollo: publicación oficial de la Asociación Estadounidense de Anatomistas, 220(4), 307-322.
- Naomi, R., Ridzuan, PM y Bahari, H. (2021). Conocimientos actuales sobre el colágeno tipo I. Polímeros (Basilea), 13(16). doi:10.3390/polym13162642
- Olsen, BR (1995). Nuevos conocimientos sobre la función de los colágenos a partir del análisis genético. Opinión actual en biología celular, 7.(5), 720-727.
- Patel, K., Munir, D. y Santos, R. (2022). Uso beneficioso de pieles de animales para la gestión de residuos de mataderos y curtidurías: una revisión de enfoques no convencionales, innovadores y sostenibles. Investigación en ciencias ambientales y contaminación, 29. doi:10.1007/s11356-021-17101-5
- Plancke, A., Holder-Espinasse, M., Rigau, V., Manouvrier, S., Claustres, M. y Van Kien, PK (2009). La homocigosidad de un alelo nulo de COL3A1 da como resultado el síndrome de Ehlers-Danlos recesivo. Revista Europea de Genética Humana, 17(11), 1411-1416.
- Plenz, GA, Deng, MC, Robenek, H. y Völker, W. (2003). Colágenos vasculares: atención al papel del colágeno tipo VIII en la aterogénesis. Aterosclerosis, 166(1), 1-11.
- Ricard-Blum, S. (2011). La familia del colágeno. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
- Schmid, TM y Linsenmayer, TF (1990). Microscopía inmunoelectrónica del colágeno tipo X: formas supramoleculares dentro del cartílago embrionario de pollo. Dev Biol, 138(1), 53-62. doi:10.1016/0012-1606(90)90176-j
- Shen, G. (2005). El papel del colágeno tipo X en facilitar y regular la osificación endocondral del cartílago articular. Ortodoncia Craneofac Res, 8(1), 11-17. doi:10.1111/j.1601-6343.2004.00308.x
- Shuttleworth, California (1997). Colágeno tipo VIII. Int J Biochem Cell Biol, 29(10), 1145-1148. doi:10.1016/s1357-2725(97)00033-2
- Smith, SM y Melrose, J. (2019). Las interacciones colágeno tipo XI-perlecano-HS estabilizan la matriz pericelular de las células del anillo fibroso y los condrocitos, proporcionando estabilización de la matriz y homeostasis. Revista de histología molecular, 50(3), 285-294. doi:10.1007/s10735-019-09823-1
- Söderhäll, C., Marenholz, I., Kerscher, T., Rüschendorf, F., Esparza-Gordillo, J., Worm, M.,. . . Rohde, K. (2007). Las variantes de un nuevo gen del colágeno epidérmico (COL29A1) están asociadas con la dermatitis atópica. Biología PLoS, 5(9), e242.
- Sorushanova, A., Delgado, LM, Wu, Z., Shologu, N., Kshirsagar, A., Raghunath, R.,. . . Zeugolis, DI (2019). La suprafamilia del colágeno: de la biosíntesis al desarrollo avanzado de biomateriales. Adv Mater, 31 años(1), e1801651. doi:10.1002/adma.201801651
- Uzawa, K., Kasamatsu, A. y Yamauchi, M. (2023). Reticulación de colágeno en el cáncer oral. Ciencia Oral Internacional, 21. doi:10.1002/osi2.1182
- van der Rest, M. y Garrón, R. (1991). Familia de proteínas del colágeno. Faseb j, 5(13), 2814-2823.
- Von Der Mark, K. (2006). CAPÍTULO 1 – Estructura, Biosíntesis y Regulación Génica de Colágenos en Cartílago y Hueso. En MJ Seibel, SP Robins y JP Bilezikian (Eds.), Dinámica del metabolismo de los huesos y cartílagos (segunda edición) (págs. 3-40). Burlington: Prensa académica.
- Wolff, K., Goldsmith, LA, Katz, SI, Gilchrest, BA, Paller, AS y Leffell, DJ (2008). La dermatología de Fitzpatrick en medicina general.: McGraw-Hill Nueva York.
- YANG, CL, RUI, H., MOSLER, S., NOTBOHM, H., SAWARYN, A. y MÜLLER, PK (1993). Colágeno II del cartílago articular y el anillo fibroso: implicación funcional estructural de las modificaciones postraduccionales específicas de tejido de las moléculas de colágeno. Revista europea de bioquímica, 213.(3), 1297-1302.
