Le collagène est une protéine qui peut aider à soulager les douleurs articulaires et à récupérer les tissus mous. Cependant, de nombreux compléments existent sur le marché, et vous avez peut-être remarqué différents types de collagène, par exemple le collagène I, II, II, IV… et ainsi de suite.
Même si les différents types de collagène jouent des rôles distincts et essentiels dans l’organisme, vous n’avez pas besoin de prendre des suppléments distincts pour développer ces collagènes car ils sont tous composés des mêmes acides aminés : glycine, proline et hydroxyproline. Tant que vous consommez suffisamment de ces acides aminés au bon moment (60 à 90 minutes avant une séance d’entraînement) avec une source de vitamine C, votre corps peut produire les différents types de collagène dont vous avez besoin.
Cependant, il est bon de comprendre ce que font les différents types de collagène dans le corps, pourquoi vous devez consommer suffisamment de collagène et comment interpréter les différentes étiquettes des suppléments.
Table des matières
Qu'est-ce que le collagène?
Le collagène est un élément essentiel de la structure des tissus qui leur confère de la flexibilité. Dans les muscles, le tissu conjonctif aide à transmettre la force des contractions musculaires aux tendons et aux os.
Les protéines du tissu conjonctif changent constamment et peuvent s’adapter. Manger des protéines stimule la synthèse des protéines musculaires.
Les protéines de haute qualité et faciles à digérer sont généralement recommandées pour de meilleurs résultats. Il est intéressant de noter que des études récentes montrent que l’apport en protéines n’augmente pas la production de protéines dans le tissu conjonctif musculaire.
Cette absence d’augmentation pourrait être due à un manque de glycine et/ou de proline. Des aliments riches en collagène contenant beaucoup de glycine et de proline sont suggérés pour fournir les éléments constitutifs de la synthèse des protéines du tissu conjonctif. [1].
Dans le corps, le collagène est comme l’échafaudage qui maintient tout ensemble. Imaginez-le comme l’élément essentiel qui maintient la santé de notre peau et de nos tissus conjonctifs. [2].
Le « tissu conjonctif » est le cadre de soutien qui lie nos organes et nos tissus. Il comprend les fibroblastes et leur matrice extracellulaire, sorte d’échafaudage autour des cellules.
Cette matrice extracellulaire est vitale car elle garantit que les cellules restent ensemble, maintient leur stabilité et facilite le processus de régénération des différents tissus. [3].
Ces tissus ont besoin de collagène pour rester forts, flexibles et capables de se réparer. Le collagène fait partie de la matrice extracellulaire, qui constitue comme un réseau de soutien pour nos cellules [4].
Cette matrice apporte de la structure et aide à réguler et à renouveler nos tissus.
Pensez aux tendons, ces bandes résistantes qui relient les muscles aux os. Ils dépendent fortement du collagène, qui représente une part importante de leur poids.
La structure unique du collagène, formée d'acides aminés spécifiques comme la glycine et la proline, lui confère sa force. Ceci est particulièrement important pour que les tendons puissent résister aux contraintes et aux forces, comme celles rencontrées lors des activités sportives, contribuant ainsi à les maintenir en bonne santé et à réduire le risque de blessures. [5].
Ainsi, le collagène n’est pas seulement une protéine ; c'est un élément crucial qui maintient l'intégrité structurelle de notre corps sous contrôle.
Le collagène forme une « triple hélice », ce qui le rend solide et flexible. La triple hélice est constituée de trois chaînes polypeptidiques, ou brins de protéines, entrelacées comme une corde.
Ces chaînes sont riches en acides aminés, la glycine étant la plus abondante. La proline et l'hydroxyproline sont également cruciales pour stabiliser la structure [2, 6].
Cette combinaison de force et de flexibilité rend le collagène bien adapté pour fournir un soutien structurel aux tissus comme la peau, les tendons et les os.
Devriez-vous prendre un type de collagène spécifique ?

Le collagène de type I est prédominant dans les os, les muscles et le tissu conjonctif. Il n’y a pas encore suffisamment de recherches pour affirmer que la consommation de collagène de type I est supérieure à la consommation d’autres types de collagène, comme le type II ou III, car ils contiennent tous des éléments constitutifs similaires, c’est-à-dire des acides aminés.
Il est intéressant de noter que de nombreuses études utilisent également la gélatine comme source de collagène pour étudier l’impact du collagène sur le corps.
Soulignant encore une fois que la priorité principale est d’obtenir les différents acides aminés qui peuvent construire les différents types de collagène.
Cependant, comme le collagène de type I joue un rôle très important dans les os, les muscles et les tissus conjonctifs, il est logique de l’opter lors du choix d’un supplément de collagène.
Différents types de collagène
Il en existe au total 29, chacun désigné par des chiffres romains I-XXIX par ordre de leur découverte. [7, 8]. Chaque type de collagène possède des caractéristiques, des fonctions et des emplacements uniques dans le corps. [2].
Différents types de collagène présentent des différences structurelles qui les aident à exercer des fonctions corporelles différentes à différents endroits.
Sa composition et sa disposition en acides aminés déterminent la structure physique du collagène et la façon dont les molécules individuelles de collagène interagissent pour former des structures plus grandes. [2, 5, 9].
Voici comment la structure physique est liée à la diversité des types de collagène :
- Composition d'acides aminés:
La composition en acides aminés du collagène varie selon les différents types. Par exemple, les types de collagène I et II ont une teneur élevée en glycine, proline et hydroxyproline, tandis que d'autres types peuvent avoir des compositions d'acides aminés différentes. Cette variation influence la force, la flexibilité et la stabilité de la structure du collagène. [9].
- Structure triple hélice :
La « triple hélice » fait référence à la façon dont le collagène est assemblé. Chaque structure est constituée de trois chaînes polypeptidiques enroulées les unes autour des autres, presque comme une corde.
Chacune de ces chaînes est connue sous le nom de Alpha chaîne (rappelez-vous-en car nous y ferons référence plus tard dans cet article). Le type spécifique de collagène est déterminé par la disposition de ces chaînes alpha et les caractéristiques de la structure du collagène qui en résulte.
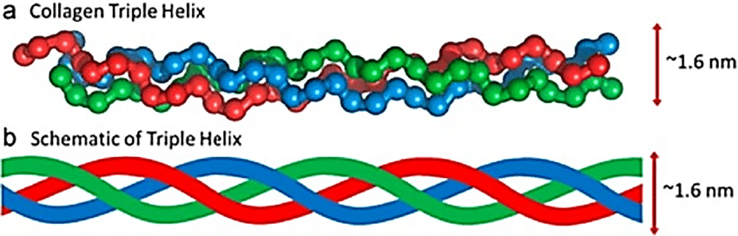
Figure 1 : La structure en triple hélice du collagène [10]
- Formation de fibrilles :
Les molécules de collagène s'assemblent en structures plus grandes telles que des fibrilles et des fibres [2, 9].
Les « fibrilles » font référence à de minuscules structures filiformes plus petites que les fibres mais plus grandes que les molécules individuelles. Imaginez-les comme des fils ou des brins miniatures qui forment une structure plus grande. Dans le contexte du collagène, les fibrilles sont les éléments constitutifs des fibres de collagène.
Imaginez une corde composée de nombreux petits fils torsadés ensemble. Chacun de ces fils peut être comparé à une fibrille.
Ces fibrilles unissent leurs forces pour créer une structure plus importante et plus solide, semblable à la façon dont les fils d'une corde se combinent pour former une corde robuste et durable.
La manière dont ces structures se forment et les interactions entre les molécules de collagène influencent les propriétés physiques des tissus.
- Réticulation :
Les fibres de collagène sont stabilisées par des liaisons chimiques réticulées entre les molécules de collagène adjacentes. Le modèle et l’étendue de la réticulation contribuent à la force et à la résilience des tissus riches en collagène, comme le montre la figure 2.
Différents types de collagène peuvent présenter des variations dans les modèles de réticulation, affectant les caractéristiques physiques des tissus [11].
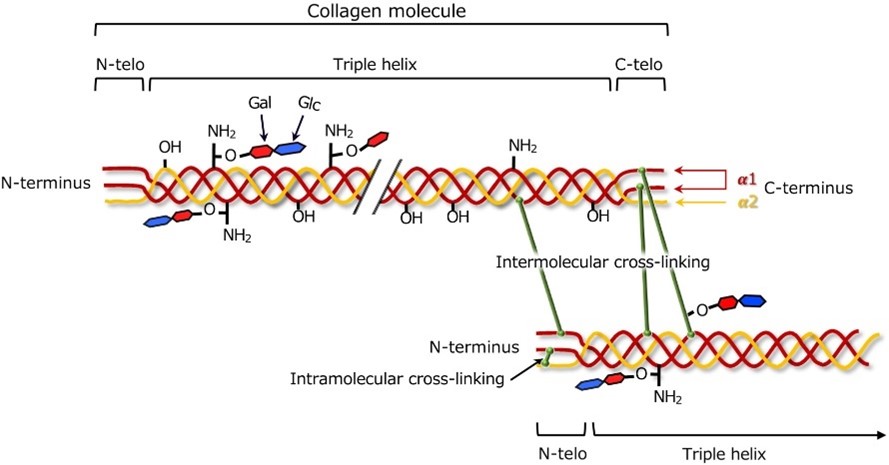
Figure 2 : Réticulation du collagène [12]
Selon la façon dont ils sont installés dans les tissus, les collagènes sont génétiquement différents et classés en sous-groupes. [13].
Les collagènes comme I, II, III, V et X s'associent pour créer de grosses fibrilles à l'extérieur des cellules, ce qui leur vaut le nom de collagènes formateurs de fibrilles.
Le collagène de type IV, quant à lui, forme un réseau entrecroisé dans les membranes basales. Ensuite, il y a le collagène de type VI, qui produit des microfibrilles uniques, et le collagène de type VII, qui crée des fibrilles d'ancrage.
Un groupe appelé collagènes FACIT [14] (collagènes associés aux fibrilles avec triple hélices interrompues), y compris les types IX, XII, XIV, XIX, XX et XXI, s'associent aux plus grosses fibres de collagène, agissant comme des ponts moléculaires.
Leur travail consiste à maintenir la matrice extracellulaire organisée et stable. C'est comme s'ils formaient l'équipe de soutien qui veillait à ce que tout reste en place.
de type I

Le collagène de type I est un élément constitutif essentiel présent dans nos os, notre peau et nos tissus conjonctifs. [15]. Ce n’est pas seulement le type de collagène le plus abondant, mais il joue également un rôle essentiel dans le maintien de la structure et de la résistance de ces tissus.
Considérez-le comme l’architecte principal, formant le cadre de base des différentes parties de notre corps. Les scientifiques ont étudié de manière approfondie le collagène de type I en raison de son importance, ce qui en fait le type de collagène le plus étudié.
C’est un composant fondamental de presque tous les tissus conjonctifs, formant la structure principale de la membrane interstitielle qui soutient et maintient notre corps ensemble.
Au-delà de sa signification structurelle, Le collagène de type I trouve des applications dans divers scénarios médicaux, notamment les interventions chirurgicales, la cicatrisation des plaies et l'ingénierie tissulaire. [16], démontrant sa polyvalence et son importance dans la promotion de la santé et du rétablissement.
Type II
Laissez-moi vous expliquer: Le collagène de type II est l'ingrédient principal de la structure du cartilage, qui est le matériau qui amortit et soutient vos articulations.
Environ 90 % du collagène du cartilage est du collagène de type II. [17].
Les caractéristiques uniques du collagène de type II le rendent essentiel à la résilience et aux propriétés d’absorption des chocs du cartilage, essentielles à la santé des articulations.
Le collagène de type 2 crée un réseau de minuscules fibres nécessaires à la solidité du cartilage [18, 19].
Le collagène de type II joue également un rôle important dans la croissance et les modifications des cellules (appelées chondrocytes) dans le développement normal du cartilage et lorsqu'une personne souffre d'arthrose (OA), une maladie qui affecte les articulations.
Lorsque le collagène de type II est perdu, il peut accélérer la croissance des chondrocytes et la progression de l’arthrose.
Cela se produit via ce qu’on appelle la voie BMP-SMAD1, qui ressemble à un système de communication au sein des cellules.
En résumé, avoir suffisamment de collagène de type II est essentiel pour garder votre cartilage en bonne santé et éviter que l’arthrose ne s’aggrave. [20].
Une étude réalisée en 2016 a montré que l’utilisation conjointe de collagène natif de type II et d’acétaminophène (un type de médicament utilisé pour traiter l’arthrose) fonctionne mieux pour soulager les symptômes chez les personnes souffrant d’arthrose du genou que d’utiliser uniquement de l’acétaminophène.
Ainsi, combiner ces deux traitements semble plus efficace pour aider les patients à gérer leurs symptômes d’arthrose du genou. [21].
Type III

Découvert en 1971, le collagène de type III est un acteur majeur de la famille du collagène, constituant environ 5 à 20 % de la teneur totale en collagène de notre corps. C'est comme un élément fondamental contribuant à l'intégrité structurelle [22].
Le collagène de type III est également appelé chaîne alpha-1 (III) de collagène ou chaîne alpha 1 du collagène de type III. [23] (rappelez-vous que nous avons mentionné que les chaînes alpha sont les « cordes » individuelles qui composent la structure à triple hélice du collagène).
Le collagène de type III est une protéine codée par le gène COL3A1 chez l'homme (cela signifie que le gène demande au corps de fabriquer du collagène de type III). [23].
On le trouve en quantités importantes dans les gros vaisseaux sanguins, l'utérus et l'intestin et sert de composant structurel, fournissant essentiellement un échafaudage pour ces organes creux.
Mais son importance va au-delà de la structure. Il interagit avec les plaquettes de notre sang, contribuant ainsi au processus de coagulation, et agit également comme une molécule de signalisation pendant la cicatrisation des plaies.
L’importance du collagène de type III devient encore plus claire lors de l’étude d’individus présentant des mutations du gène COL3A1.
Ces mutations peuvent entraîner des problèmes graves tels que des ruptures spontanées des artères, de l'utérus et de l'intestin (votre intestin).
Cela met en évidence le rôle indispensable du collagène de type III dans le maintien de la structure intacte de ces organes. [24, 25, 26].
Il est intéressant de noter que les mutations du gène COL3A1 peuvent également entraîner de graves anomalies cérébrales. Cela suggère que le collagène de type III n’est pas seulement une question de structure physique.
C'est également primordial pour le développement normal du cerveau [27, 28, 29].
Ainsi, en plus d’être un moteur structurel, le collagène de type III joue un rôle vital dans tout notre corps, influençant à la fois la structure physique et les processus fonctionnels.
Type IV
Le collagène de type IV est une protéine distribuée dans plusieurs tissus, en particulier dans une zone appelée membrane basale.
On peut le trouver à divers endroits du corps, comme les cheveux, les surfaces cellulaires et le placenta. [30].
Ce qui rend le collagène de type IV intéressant, c’est sa structure. À la fin de sa chaîne (C-terminale), il y a ce qu'on appelle le domaine C4, et contrairement aux autres collagènes, il n'est pas éliminé pendant le processus de fabrication des protéines.
Cette caractéristique unique permet aux fibres de collagène de se relier tête à tête plutôt que côte à côte. [30].
Le collagène de type IV ne possède pas d’acide aminé spécifique (glycine) dans une position sur trois de sa chaîne, ce qui est typique des autres types de collagène.
Cette absence rend le collagène de type IV plus flexible et courbé dans sa forme générale que les autres variétés de collagène. [31].
En raison de ces caractéristiques structurelles, le collagène de type IV possède une capacité particulière : il peut former des feuilles. Ces feuilles constituent une partie importante de la composition structurelle de la membrane basale de la peau.
Cela signifie que le collagène de type IV a une structure distincte qui lui permet de créer des feuilles flexibles et incurvées, et vous constaterez qu'il joue un rôle clé dans la structure de la membrane basale de la peau. [32, 33].
Type V
Le collagène de type V est comme un collagène « gestionnaire » qui aide à réguler la formation de fibrilles (qui sont comme des fils de collagène).
Il existe au moins trois versions différentes : α1(V)2, α2(V), α1(V)3 et α1(V)α2(V)α3(V). Ces versions sont créées en combinant trois chaînes alpha différentes – α1(V), α2(V) et α3(V) [34].
Le collagène de type V n’est pas le personnage principal de l’histoire de la matrice extracellulaire ; c'est plutôt un acteur de soutien. Il se lie à d’autres collagènes comme le collagène de type I, formant ces fibrilles mixtes ou fils fins aux caractéristiques distinctes. [35].
Les cellules de diverses parties de notre corps produisent du collagène de type V, et sa production est influencée par des facteurs tels que le TGF-β (facteur de croissance transformant bêta) et d'autres facteurs de croissance. [36].
Même s'il peut résister à la digestion par certaines enzymes [37], ce n'est pas invincible – les métalloprotéinases et les gélatinases (certaines enzymes du corps) peuvent le décomposer, contribuant ainsi au remodelage (construction) de la matrice extracellulaire [38].
Le collagène de type V est comme un joueur d’équipe. Il interagit avec d’autres types de collagène et protéines structurelles, renforçant ainsi la structure de nos tissus.
Il interagit également avec les macromolécules matricielles, influençant le comportement et le fonctionnement des cellules de notre corps. [37]. Le collagène de type V joue un rôle crucial dans le maintien de la structure et de la fonction de nos tissus.
Type VI
Le collagène VI joue divers rôles dans les tissus où il se trouve, remplissant des fonctions mécaniques, protégeant les cellules en inhibant l'apoptose (mort cellulaire programmée) et protégeant contre les dommages oxydatifs.
Il contribue également au développement et à la progression des tumeurs en influençant la différenciation cellulaire et les mécanismes autophagiques. [39].
Ce type de collagène joue un rôle dans l’ancrage des cellules et des tissus, contribuant ainsi à la stabilité globale de la matrice extracellulaire.
TypeVII
Le collagène de type VII tire son nom du fait qu’au début, les gens pensaient qu’il s’agissait d’une molécule extra-longue, c’est pourquoi ils l’appelaient collagène à longue chaîne.
Ce collagène est important dans la formation des fibrilles d'ancrage, qui sont comme des poutres de support assurant la stabilité de la façon dont la couche externe de la peau (épiderme) adhère à la couche plus profonde (derme) au niveau d'une interface spécifique appelée lamina lucida/derme papillaire [40].
Type VIII
Le collagène de type VIII est produit par plusieurs types de cellules, notamment les cellules endothéliales (celles qui tapissent les vaisseaux sanguins), les kératinocytes (cellules de la couche externe de la peau), les mastocytes (un type de cellule immunitaire) et les cellules endothéliales microvasculaires (minuscules vaisseaux sanguins). , et même certaines cellules tumorales.
On peut le trouver dans différentes matrices extracellulaires, comme dans la partie blanche de vos yeux (sclérotique), la peau et les minuscules filtres de vos reins (glomérule) [6, 41].
En ce qui concerne sa structure, le collagène de type VIII est constitué de deux chaînes alpha, plus précisément [alpha 1(VIII)2 alpha 2(VIII)] [42].
Son rôle dans l’organisme est encore inconnu, même si des études récentes suggèrent qu’il est relativement important dans les vaisseaux sanguins.
Certaines recherches indiquent qu’il pourrait jouer un rôle dans le mouvement des cellules musculaires lisses, essentiel au maintien de la structure des vaisseaux sanguins.
Les chercheurs pensent que le collagène de type VIII pourrait agir comme une sorte de base pour diverses cellules, aidant les cellules endothéliales à se déplacer pendant la formation de nouveaux vaisseaux sanguins (angiogenèse), aidant les cellules musculaires lisses à pénétrer dans la couche interne des vaisseaux sanguins (invasion intimale) et aider les myofibroblastes lors de la cicatrisation des tissus (conditions fibrotiques) [43].
Type X
Le collagène de type X est un membre spécial de la famille du collagène à chaîne courte, présent principalement dans le cartilage et crucial pour la croissance et le développement des os.
On le trouve principalement dans les plaques de croissance des os, où la formation de nouveaux os se produit au cours du développement et de la croissance.
La fonction première du collagène de type X est de contribuer au développement et à la minéralisation des os, notamment au niveau des cartilages de croissance.
C'est comme un marqueur d'un type spécifique de cellules cartilagineuses matures appelées « chondrocytes hypertrophiques ». [44]. Chez l'homme, jusqu'à 18 % de la synthèse de collagène dans certaines régions peut être de type X.
On pense que son rôle facilite le processus de calcification, influençant potentiellement l’organisation de la matrice cartilagineuse.
Les chercheurs pensent que le collagène de type X est essentiel à la compréhension de la croissance et de la différenciation des chondrocytes. Des mutations de ce type de collagène pourraient être liées à certains troubles du développement osseux [45].
Dans l’ensemble, le collagène de type X offre une perspective sur la biologie du cartilage, aidant les chercheurs à en apprendre davantage sur la croissance et le développement osseux.
Type XI
Le collagène de type XI joue un rôle dans la structure structurelle du corps.
Agissant comme un collagène fibrillaire, il est répandu dans divers tissus comme le cartilage articulaire, les testicules, les tendons, les os, les muscles, le placenta, les poumons et même le néoépithélium du cerveau.
Son rôle est de réguler la fibrillogenèse, qui contribue à la formation de fibrilles de collagène – ces structures filiformes qui maintiennent nos tissus ensemble. [46].
L’une de ses fonctions est de maintenir l’espacement et le diamètre des fibrilles de collagène de type II, agissant comme un superviseur pour leur bonne formation. Il joue également un rôle dans le démarrage de la formation de collagène de types I et II. [46].
Il peut se lier à des substances comme l’héparine, l’héparane sulfate et le dermatan sulfate. Cependant, malgré son importance potentielle, nous manquons actuellement de biomarqueurs spécifiques pour mesurer le collagène de type XI. [47].
Types XII, XIV et XVI
Le collagène de type XII est comme le superviseur de certaines parties de notre corps – on le trouve principalement dans le périchondre (une couche autour du cartilage) et sur la surface articulaire.
C'est une molécule « homotrimérique », c'est-à-dire qu'elle comprend trois parties identiques. Imaginez-le comme une grande structure en forme de croix avec des domaines spécifiques qui atteignent l'espace autour des fibrilles de collagène.
Ce collagène a deux formes : une plus petite trouvée dans la peau et une autre plus grande trouvée dans les cellules épidermiques. [48].
Parlons maintenant du collagène de type XIV. C'est similaire mais avec une structure en forme de croix plus petite. Le collagène de type XIV est réparti plus uniformément dans divers tissus, interagissant avec le collagène de type I dans des endroits comme la peau, les tendons, etc. Il ne se lie pas directement au collagène de type I mais plutôt à une substance appelée décorine. [48].
Enfin, nous avons le collagène de type XVI, synthétisé par les fibroblastes et les myoblastes. Cela fait partie du spectacle dans la matrice territoriale des chondrocytes, ces cellules du cartilage.
Imaginez-le comme cet acteur intégré dans les fines fibrilles de collagène, côtoyant le collagène de types II et XI.
C'est comme une équipe en coulisses dans différentes parties de notre corps, s'assurant que les choses sont parfaitement structurées. [48].
Avez-vous besoin de tous les types de collagène ?

Pour construire du collagène dans le corps, vous devez disposer des éléments constitutifs du collagène : les acides aminés comprennent la glycine, la proline, la lysine, l'hydroxylysine et l'hydroxyproline [49].
De plus, vous avez besoin de vitamine C pour aider à former du collagène dans le corps. La vitamine C est importante pour les tissus conjonctifs car elle permet à une enzyme appelée prolyl 4-hydroxylase de faire son travail.
Cette enzyme est nécessaire pour modifier la proline, un élément constitutif des protéines, et aide à fabriquer et à libérer du procollagène.
Vous n’avez pas besoin d’absorber tous les types de collagène tant que vous consommez suffisamment de composants constitutifs – c’est-à-dire d’acides aminés – qui composent le collagène.
Les suppléments de collagène, et même la gélatine, sont tous décomposés en glycine, proline, lysine, hydroxylysine et hydroxyproline et peuvent être utilisés pour construire les différents types de collagène dans le corps.
La source de collagène est-elle importante ?
Les protéines de collagène d'origine animale peuvent ne pas convenir aux athlètes végétariens ou végétaliens.
Bien qu'il existe des produits végétaliens et végétariens conçus pour reproduire le collagène d'origine animale, s'il s'avère que les peptides propres aux protéines animales possèdent une activité biologique distincte, les alternatives végétariennes et végétaliennes pourraient être considérées comme moins efficaces.
Des recherches supplémentaires sont nécessaires pour évaluer la disponibilité des acides aminés et l’efficacité des substituts végétaliens du collagène.
Diverses sources de collagène d’origine animale présentent de légères variations dans leur teneur en acides aminés, mais les différences ne sont pas suffisamment significatives pour déclarer un type supérieur à un autre.
Tableau 1 : Composition en acides aminés des 5 principaux collagènes et gélatine de mammifères [50]
| Acide aminé | Gélatine animale | |||||||
| Peau de bœuf | Os commercial | Peau de porc | Os de bœuf | Peau de requin | Peau de poisson-poumon | Greffe Osseuse | Tendon | |
| Glycine | 27.5 | 27.2 | 26.4 | 25.3 | 26.5 | 24 | 25.8 | 25.4 |
| Leucine | 3.3 | 3.5 | 3.3 | 3.9 | 3.5 | 2.8 | 3.6 | 3.6 |
| Proline | 16.4 | 15.5 | 16.2 | 14.7 | 13.9 | 15.8 | 15.3 | 15.2 |
| hydroxyproline | 14.1 | 13.3 | 13.5 | 14.1 | 10.9 | 10.8 | 14.1 | 12.6 |
| Hydroxylysine | 1.0 | 0.7 | 1.0 | 1.1 | 0.8 | 1.1 | 0.6 | |
Meilleur type de collagène
Le débat sur la supériorité des types de collagène reste en suspens en raison de leurs profils d’acides aminés similaires. Le collagène de type I apparaît comme un choix stratégique compte tenu de son rôle crucial dans le renforcement des os, des muscles et des tissus conjonctifs.
L’accent doit être mis sur un large apport en acides aminés pour un soutien global du collagène. Mais pour des bienfaits ciblés, vous tourner vers le collagène de type I pourrait être votre meilleur pari.
Bibliographie
- Abreu-Velez, AM et Howard, MS (2012). Collagène IV dans la peau normale et dans les processus pathologiques. N Am J Med Sci, 4(1), 1-8. doi:10.4103/1947-2714.92892
- Adam, député, Feldman, J., Mirzaa, GM, Pagon, RA, Wallace, SE, Bean, LJ, . . . Amemiya, A. (1993). GeneReviews®[Internet].
- Alcaide-Ruggiero, L., Molina-Hernández, V., Granados, MM et Domínguez, JM (2021). Types principaux et mineurs de collagènes dans le cartilage articulaire : le rôle des collagènes dans l'évaluation des tissus réparateurs dans les anomalies chondrales. Int J Mol Sci, 22(24). est ce que je:10.3390/ijms222413329
- Aycock, RS et Seyer, JM (1989). Collagènes du foie humain normal et cirrhotique. Recherche sur le tissu conjonctif, 23(1), 19-31.
- Baar, K. (2017). Minimiser les blessures et maximiser le retour au jeu : leçons tirées des ligaments techniques. Médecine sportive, 47 ans(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
- Bakilan, F., Armagan, O., Ozgen, M., Tascioglu, F., Bolluk, O. et Alatas, O. (2016). Effets du traitement au collagène natif de type II sur l'arthrose du genou : un essai contrôlé randomisé. Eurasienne J Med, 48 ans(2), 95-101. doi:10.5152/eurasianjmed.2015.15030
- Birk, DE (2001). Collagène de type V : interactions hétérotypiques du collagène de type I/V dans la régulation de l’assemblage des fibrilles. Microns, 32(3), 223-237.
- Byers, PH, Belmont, J., Black, J., De Backer, J., Frank, M., Jeunemaitre, X., . . . Sanders, L. (2017). Diagnostic, histoire naturelle et prise en charge du syndrome vasculaire d'Ehlers-Danlos. Article présenté à l'American Journal of Medical Genetics Part C: Seminars in Medical Genetics.
- Cao, Q., Mak, KM et Lieber, CS (2002). Le DLPC diminue l'ARNm du collagène induit par le TGF-β1 en inhibant p38 MAPK dans les cellules étoilées hépatiques. Journal américain de physiologie-physiologie gastro-intestinale et hépatique, 283(5), G1051-G1061.
- Chung, HJ et Uitto, J. (2010). Collagène de type VII : la protéine fibrille d'ancrage en cause dans l'épidermolyse bulleuse dystrophique. Clinique Dermatol, 28(1), 93-105. doi:10.1016/j.det.2009.10.011
- Clifford, T., Ventress, M., Allerton, DM, Stansfield, S., Tang, JCY, Fraser, WD, . . . Stevenson, E. (2019). Les effets des peptides de collagène sur les lésions musculaires, l'inflammation et le renouvellement osseux après l'exercice : un essai randomisé et contrôlé. Acides aminés, 51(4), 691-704. doi:10.1007/s00726-019-02706-5
- Di Martino, A., Cescon, M., D'Agostino, C., Schilardi, F., Sabatelli, P., Merlini, L. et Faldini, C. (2023). Collagène VI dans le système musculo-squelettique. Int J Mol Sci, 24(6). est ce que je:10.3390/ijms24065095
- Dong, C. et Lv, Y. (2016). Application de l'échafaudage de collagène en ingénierie tissulaire : avancées récentes et nouvelles perspectives. Polymères (Bâle), 8(2). est ce que je:10.3390/polym8020042
- Ellingson, AJ, Pancheri, NM et Schiele, NR (2022). Régulateurs de la réticulation du collagène dans les tendons en développement et adultes. Eur Cell Mater, 43, 130-152. doi:10.22203/eCM.v043a11
- Frantz, C., Stewart, KM et Weaver, VM (2010). La matrice extracellulaire en un coup d'œil. J Cell Sci, 123(Partie 24), 4195-4200. est ce que je:10.1242/jcs.023820
- Hasegawa, H., Naito, I., Nakano, K., Momota, R., Nishida, K., Taguchi, T., . . . Ohtsuka, A. (2007). Les distributions des chaînes α de collagène de type IV dans les membranes basales de l'épiderme humain et des annexes cutanées. Archives d'histologie et de cytologie, 70(4), 255-265.
- Holwerda, AM et van Loon, LJC (2022). L'impact de l'ingestion de protéines de collagène sur le remodelage du tissu conjonctif musculo-squelettique : une revue narrative. Nutr Rev, 80(6), 1497-1514. doi:10.1093/nutrit/nuab083
- Horn, D., Siebert, E., Seidel, U., Rost, I., Mayer, K., Abou Jamra, R., . . . Kornak, U. (2017). Les mutations bialléliques COL3A1 entraînent un spectre clinique d'anomalies structurelles spécifiques du cerveau et d'anomalies du tissu conjonctif. Journal américain de génétique médicale Partie A, 173(9), 2534-2538.
- Jørgensen, A., Fagerheim, T., Rand-Hendriksen, S., Lunde, PI, Vorren, TO, Pepin, MG, . . . Byers, PH (2015). Syndrome vasculaire d'Ehlers – Danlos chez les frères et sœurs avec des variantes de séquence bialléliques COL3A1 et une variabilité clinique marquée dans la famille élargie. Journal européen de génétique humaine, 23(6), 796-802.
- Kannus, P. (2000). Structure du tissu conjonctif tendineux. Scand J Med Sci Sports, 10 ans(6), 312-320. doi:10.1034/j.1600-0838.2000.010006312.x
- Kapandji, I. (1977). La physiologie des articulations. Churchill Livingstone, 2, 186-189.
- Khoshnoodi, J., Pedchenko, V. et Hudson, BG (2008). Collagène de mammifère IV. Tech Rés Microsc, 71(5), 357-370. doi:10.1002/jemt.20564
- Konomi, H., Hayashi, T., Nakayasu, K. et Arima, M. (1984). Localisation du collagène de type V et du collagène de type IV dans la cornée, les poumons et la peau humains. Preuve immunohistochimique par anticorps anti-collagène caractérisés par immunoélectroblot. Le journal américain de pathologie, 116.(3), 417.
- Kuivaniemi, H. et Tromp, G. (2019). Collagène de type III (COL3A1) : structure des gènes et des protéines, distribution tissulaire et maladies associées. Gène, 707, 151-171. est ce que je:10.1016/j.gene.2019.05.003
- Lian, C., Wang, X., Qiu, X., Wu, Z., Gao, B., Liu, L., . . . Peng, Y. (2019). Le collagène de type II supprime l’hypertrophie articulaire des chondrocytes et la progression de l’arthrose en favorisant l’interaction de l’intégrine β1− SMAD1. Recherche osseuse, 7(1), 8.
- Luo, YY et Karsdal, MA (2016). Chapitre 11 – Collagène de type XI. Dans MA Karsdal (éd.), Biochimie des Collagènes, Laminines et Élastine (pp. 77-80) : Presse académique.
- Mak, KM, Png, CY et Lee, DJ (2016). Collagène de type V dans la santé, les maladies et la fibrose. Anat Rec (Hoboken), 299(5), 613-629. doi:10.1002/ar.23330
- Malfait, F., Francomano, C., Byers, P., Belmont, J., Berglund, B., Black, J., . . . Burrows, PN (2017). La classification internationale 2017 des syndromes d'Ehlers-Danlos. Article présenté à l'American Journal of Medical Genetics Part C: Seminars in Medical Genetics.
- Miller, EJ, Epstein Jr, EH et Piez, KA (1971). Identification de trois collagènes génétiquement distincts par clivage au bromure de cyanogène du collagène insoluble de la peau humaine et du cartilage. Communications sur la recherche biochimique et biophysique, 42(6), 1024-1029.
- Moriya, K., Bae, E., Honda, K., Sakai, K., Sakaguchi, T., Tsujimoto, I., . . . Sakai, T. (2011). Un mécanisme indépendant de la fibronectine de la fibrillogenèse du collagène dans le remodelage du foie adulte. Gastro-entérologie, 140(5), 1653-1663.
- Muragaki, Y., Jacenko, O., Apte, S., Mattei, M., Ninomiya, Y. et Olsen, BR (1991). Le gène du collagène alpha 2 (VIII). Un nouveau membre de la famille du collagène à chaîne courte situé sur le chromosome 1 humain. Journal de chimie biologique, 266(12), 7721-7727.
- Myllyharju, J. et Kivirikko, KI (2004). Collagènes, enzymes modificatrices et leurs mutations chez l'homme, les mouches et les vers. TENDANCES en génétique, 20(1), 33-43.
- Nah, HD, Swoboda, B., Birk, DE et Kirsch, T. (2001). Procollagène de type IIA : expression dans le cartilage des membres de poulet en développement et le cartilage articulaire arthrosique humain. Dynamique du développement : une publication officielle de l'Association américaine des anatomistes, 220(4), 307-322.
- Naomi, R., Ridzuan, PM et Bahari, H. (2021). Aperçus actuels sur le collagène de type I. Polymères (Bâle), 13(16). est ce que je:10.3390/polym13162642
- Olsen, BR (1995). Nouvelles connaissances sur la fonction des collagènes grâce à l’analyse génétique. Opinion actuelle en biologie cellulaire, 7(5), 720-727.
- Patel, K., Munir, D. et Santos, R. (2022). Utilisation bénéfique des peaux d'animaux pour la gestion des déchets des abattoirs et des tanneries : un examen des approches non conventionnelles, innovantes et durables. Sciences de l'environnement et recherche sur la pollution, 29. doi:10.1007/s11356-021-17101-5
- Plancke, A., Holder-Espinasse, M., Rigau, V., Manouvrier, S., Claustres, M. et Van Kien, PK (2009). L'homozygotie pour un allèle nul de COL3A1 entraîne un syndrome d'Ehlers-Danlos récessif. Journal européen de génétique humaine, 17(11), 1411-1416.
- Plenz, GA, Deng, MC, Robenek, H. et Völker, W. (2003). Collagènes vasculaires : coup de projecteur sur le rôle du collagène de type VIII dans l'athérogenèse. Athérosclérose, 166(1), 1-11.
- Ricard-Blum, S. (2011). La famille du collagène. Cold Spring Harb Perspective Biol, 3(1), a004978. est ce que je:10.1101/cshperspect.a004978
- Schmid, TM et Linsenmayer, TF (1990). Microscopie immunoélectronique du collagène de type X : formes supramoléculaires au sein du cartilage embryonnaire de poulet. Dev Biol, 138(1), 53-62. doi:10.1016/0012-1606(90)90176-j
- Shen, G. (2005). Le rôle du collagène de type X dans la facilitation et la régulation de l'ossification endochondrale du cartilage articulaire. Orthod Craniofac Res, 8(1), 11-17. doi:10.1111/j.1601-6343.2004.00308.x
- Shuttleworth, Californie (1997). Collagène de type VIII. Int J Biochem Cell Biol, 29(10), 1145-1148. doi:10.1016/s1357-2725(97)00033-2
- Smith, SM et Melrose, J. (2019). Les interactions collagène-perlécan-HS de type XI stabilisent la matrice péricellulaire des cellules de l'anneau fibreux et des chondrocytes, assurant la stabilisation et l'homéostasie de la matrice. Journal d'histologie moléculaire, 50(3), 285-294. doi:10.1007/s10735-019-09823-1
- Söderhäll, C., Marenholz, I., Kerscher, T., Rüschendorf, F., Esparza-Gordillo, J., Worm, M., . . . Rohde, K. (2007). Des variantes d'un nouveau gène du collagène épidermique (COL29A1) sont associées à la dermatite atopique. Biologie PLoS, 5(9), EX242.
- Sorushanova, A., Delgado, LM, Wu, Z., Shologu, N., Kshirsagar, A., Raghunath, R., . . . Zeugolis, DI (2019). La suprafamille du collagène : de la biosynthèse au développement avancé de biomatériaux. Av. Mater, 31 ans(1), e1801651. est ce que je:10.1002/adma.201801651
- Uzawa, K., Kasamatsu, A. et Yamauchi, M. (2023). Réticulation du collagène dans le cancer de la bouche. Internationale des sciences orales, 21. est ce que je:10.1002/osi2.1182
- van der Rest, M. et Garrone, R. (1991). Famille de protéines du collagène. Faseb j, 5(13), 2814-2823.
- En ligneVon Der Mark, K. (2006). CHAPITRE 1 – Structure, biosynthèse et régulation génique des collagènes du cartilage et des os. Dans MJ Seibel, SP Robins et JP Bilezikian (éd.), Dynamique du métabolisme osseux et cartilagineux (deuxième édition) (p. 3-40). Burlington : Presse académique.
- Wolff, K., Goldsmith, LA, Katz, SI, Gilchrest, BA, Paller, AS et Leffell, DJ (2008). Dermatologie de Fitzpatrick en médecine générale: McGraw-Hill New York.
- YANG, CL, RUI, H., MOSLER, S., NOTBOHM, H., SAWARYN, A. et MÜLLER, PK (1993). Collagène II du cartilage articulaire et de l'anneau fibreux : implication structurelle et fonctionnelle des modifications post-traductionnelles spécifiques aux tissus des molécules de collagène. Revue européenne de biochimie, 213.(3), 1297-1302.
