Il collagene è una proteina che può aiutare con dolori articolari e recupero dei tessuti molli. Tuttavia, sul mercato esistono molti integratori e potresti aver notato diversi tipi di collagene, ad esempio il collagene I, II, II, IV... e così via.
Anche se i diversi tipi di collagene hanno ruoli distinti ed essenziali nel corpo, non è necessario assumere integratori separati per costruire questi collageni poiché sono tutti composti dagli stessi amminoacidi: glicina, prolina e idrossiprolina. Finché assumi una quantità sufficiente di questi aminoacidi al momento giusto (60 – 90 minuti prima di un allenamento) con una fonte di vitamina C, il tuo corpo può costruire i diversi tipi di collagene di cui hai bisogno.
Tuttavia, è bene capire cosa fanno i diversi tipi di collagene nel corpo, perché è necessario assumere abbastanza collagene e come interpretare le diverse etichette degli integratori.
Sommario
Cos'è il collagene?
Il collagene è una parte vitale della struttura dei tessuti che conferisce loro flessibilità. Nei muscoli, il tessuto connettivo aiuta a trasmettere la forza delle contrazioni muscolari ai tendini e alle ossa.
Le proteine nel tessuto connettivo cambiano costantemente e possono adattarsi. Mangiare proteine aumenta la sintesi delle proteine muscolari.
Le proteine di alta qualità e facili da digerire sono generalmente consigliate per ottenere i migliori risultati. È interessante notare che studi recenti dimostrano che l'assunzione di proteine non aumenta la produzione di proteine nel tessuto connettivo muscolare.
Questo mancato aumento potrebbe essere dovuto a un’insufficienza di glicina e/o prolina. Si suggerisce che gli alimenti ricchi di collagene contenenti molta glicina e prolina forniscano gli elementi costitutivi per la sintesi proteica del tessuto connettivo [1].
Nel corpo, il collagene è come l’impalcatura che tiene insieme tutto. Immaginatelo come l'elemento essenziale che mantiene la salute della nostra pelle e dei tessuti connettivi [2].
Il “tessuto connettivo” è la struttura di supporto che lega i nostri organi e tessuti. Comprende i fibroblasti e la loro matrice extracellulare, una sorta di impalcatura attorno alle cellule.
Questa matrice extracellulare è vitale perché garantisce che le cellule restino unite, mantenga la stabilità e aiuti il processo di rigenerazione nei diversi tessuti [3].
Questi tessuti hanno bisogno di collagene per rimanere forti, flessibili e capaci di autoripararsi. Il collagene fa parte della matrice extracellulare, che è come una rete di supporto per le nostre cellule [4].
Questa matrice fornisce struttura e aiuta a regolare e rinnovare i nostri tessuti.
Pensa ai tendini, le robuste fasce che collegano i muscoli alle ossa. Fanno molto affidamento sul collagene, che costituisce una parte significativa del loro peso.
La struttura unica del collagene, formata da aminoacidi specifici come la glicina e la prolina, gli conferisce forza. Ciò è particolarmente importante affinché i tendini resistano alle sollecitazioni e alle forze, come quelle incontrate durante le attività sportive, contribuendo a mantenerli sani e riducendo il rischio di infortuni [5].
Quindi, il collagene non è solo una proteina; è un elemento cruciale che tiene sotto controllo l'integrità strutturale del nostro corpo.
Il collagene forma una “tripla elica”, che lo aiuta a essere forte e flessibile. La tripla elica è costituita da tre catene polipeptidiche, o filamenti proteici, intrecciati come una corda.
Queste catene sono ricche di aminoacidi, di cui la glicina è la più abbondante. Anche la prolina e l'idrossiprolina sono fondamentali per stabilizzare la struttura [2, 6].
Questa combinazione di forza e flessibilità rende il collagene adatto a fornire supporto strutturale a tessuti come pelle, tendini e ossa.
Dovresti prendere un tipo specifico di collagene?

Il collagene di tipo I è predominante nelle ossa, nei muscoli e nel tessuto connettivo. Non c'è ancora abbastanza ricerca per affermare che il consumo di collagene di tipo I è superiore al consumo di altri tipi di collagene, come il tipo II o III, perché contengono tutti elementi costitutivi simili, ovvero aminoacidi.
È interessante notare che molti studi utilizzano anche la gelatina come fonte di collagene quando studiano l’impatto del collagene sul corpo.
Sottolineando ancora una volta che la priorità principale è ottenere i diversi aminoacidi che possono costruire i vari tipi di collagene.
Tuttavia, poiché il collagene di tipo I svolge un ruolo così significativo nelle ossa, nei muscoli e nei tessuti connettivi, ha senso optare per questo quando si sceglie un integratore di collagene.
Diversi tipi di collagene
Ne esistono 29 in totale, ciascuno indicato con i numeri romani I-XXIX in ordine di scoperta [7, 8]. Ogni tipo di collagene ha caratteristiche, funzioni e posizioni uniche all’interno del corpo [2].
Diversi tipi di collagene presentano differenze strutturali che li aiutano a svolgere diverse funzioni corporee in luoghi diversi.
La sua composizione e disposizione di aminoacidi determinano la struttura fisica del collagene e il modo in cui le singole molecole di collagene interagiscono per formare strutture più grandi [2, 5, 9].
Ecco come la struttura fisica è correlata alla diversità dei tipi di collagene:
- Composizione degli amminoacidi:
La composizione aminoacidica del collagene varia tra i diversi tipi. Ad esempio, i tipi di collagene I e II hanno un elevato contenuto di glicina, prolina e idrossiprolina, mentre altri tipi possono avere composizioni di aminoacidi diverse. Questa variazione influenza la forza, la flessibilità e la stabilità della struttura del collagene [9].
- Struttura a tripla elica:
La “tripla elica” si riferisce al modo in cui il collagene viene assemblato. Ogni struttura è costituita da tre catene polipeptidiche attorcigliate l'una attorno all'altra, quasi come una corda.
Ognuna di queste catene è conosciuta come an alfa catena (ricordatelo perché ne faremo riferimento più avanti in questo post). Il tipo specifico di collagene è determinato dalla disposizione di queste catene alfa e dalle caratteristiche della struttura del collagene risultante.
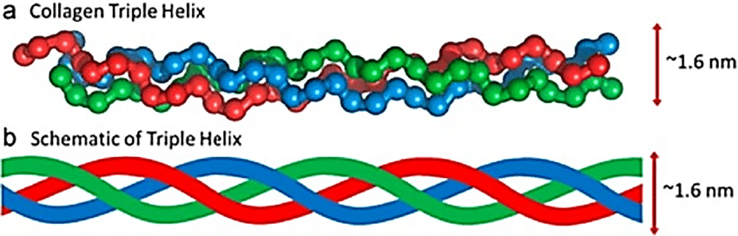
Figura 1: La struttura a tripla elica del collagene [10]
- Formazione di fibrille:
Le molecole di collagene si assemblano in strutture più grandi come fibrille e fibre [2, 9].
Le “fibrille” si riferiscono a minuscole strutture filiformi più piccole delle fibre ma più grandi delle singole molecole. Immaginateli come fili o fili in miniatura che formano una struttura più grande. Nel contesto del collagene, le fibrille sono gli elementi costitutivi delle fibre di collagene.
Immaginate una corda fatta di tanti piccoli fili intrecciati insieme. Ciascuno di questi fili può essere paragonato ad una fibrilla.
Queste fibrille uniscono le forze per creare una struttura più significativa e più forte, simile a come i fili di una corda si combinano per formare una corda robusta e durevole.
Il modo in cui si formano queste strutture e le interazioni tra le molecole di collagene influenzano le proprietà fisiche dei tessuti.
- Reticolazione:
Le fibre di collagene vengono stabilizzate mediante reticolazione, legami chimici tra molecole di collagene adiacenti. Il modello e l'entità della reticolazione contribuiscono alla forza e alla resilienza dei tessuti ricchi di collagene, come mostrato nella Figura 2.
Diversi tipi di collagene possono presentare variazioni nei modelli di reticolazione, influenzando le caratteristiche fisiche dei tessuti [11].
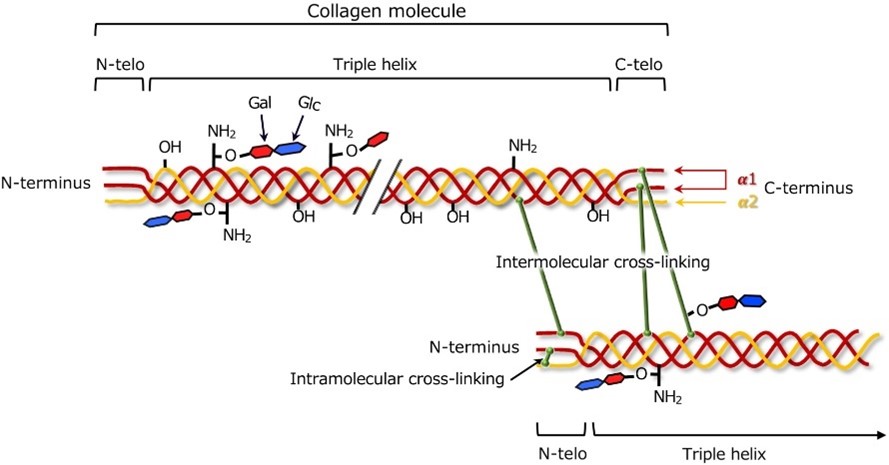
Figura 2: reticolazione del collagene [12]
In base alla loro struttura nei tessuti, i collageni sono geneticamente diversi e suddivisi in sottogruppi [13].
I collageni come I, II, III, V e X si uniscono per creare grandi fibrille all'esterno delle cellule, guadagnandosi il nome di collageni che formano fibrille.
Il collagene di tipo IV, invece, forma una rete incrociata nelle membrane basali. Poi c'è il collagene di tipo VI, che crea microfibrille uniche, e il collagene di tipo VII, che crea fibrille di ancoraggio.
Un gruppo chiamato collageni FACIT [14] (collagene associati alle fibrille con tripla elica interrotta), compresi i tipi IX, XII, XIV, XIX, XX e XXI, si uniscono alle fibre di collagene più grandi, agendo come ponti molecolari.
Il loro compito è mantenere la matrice extracellulare organizzata e stabile. È come se fossero la squadra di supporto che garantisce che tutto rimanga a posto.
tipo I

Il collagene di tipo I è un elemento fondamentale che si trova nelle nostre ossa, nella pelle e nei tessuti connettivi [15]. Non è solo il tipo di collagene più abbondante, ma svolge anche un ruolo vitale nel mantenimento della struttura e della forza di questi tessuti.
Consideratelo come l'architetto principale, che forma la struttura di base per varie parti del nostro corpo. Gli scienziati hanno studiato approfonditamente il collagene di tipo I per la sua importanza, rendendolo il tipo di collagene più studiato.
È un componente fondamentale in quasi tutti i tessuti connettivi, formando la struttura primaria della membrana interstiziale che sostiene e tiene insieme il nostro corpo.
Al di là del suo significato strutturale, Il collagene di tipo I trova applicazioni in diversi scenari medici, tra cui procedure chirurgiche, guarigione delle ferite e ingegneria dei tessuti [16], dimostrando la sua versatilità e importanza nel promuovere la salute e il recupero.
tipo II
Fammi scomporre per te: Il collagene di tipo II è l'ingrediente principale nella struttura della cartilagine, che è il materiale che ammortizza e sostiene le articolazioni.
Circa il 90% del collagene nella cartilagine è collagene di tipo II [17].
Le caratteristiche uniche del collagene di tipo II lo rendono essenziale per la resilienza e le proprietà di assorbimento degli urti della cartilagine, che sono cruciali per la salute delle articolazioni.
Il collagene di tipo 2 crea una rete di minuscole fibre necessarie per la resistenza della cartilagine [18, 19].
Il collagene di tipo II svolge anche un ruolo importante nella crescita e nei cambiamenti delle cellule (chiamate condrociti) nel normale sviluppo della cartilagine e quando qualcuno soffre di osteoartrite (OA), una condizione che colpisce le articolazioni.
La perdita del collagene di tipo II può accelerare la crescita dei condrociti e la progressione dell’osteoartrosi.
Avviene attraverso qualcosa chiamato percorso BMP-SMAD1, che è come un sistema di comunicazione all'interno delle cellule.
Quindi, in poche parole, avere abbastanza collagene di tipo II è essenziale per mantenere la cartilagine sana e prevenire il peggioramento dell’osteoartrite. [20].
Uno studio condotto nel 2016 ha dimostrato che l’uso combinato di collagene nativo di tipo II e paracetamolo (un tipo di farmaco usato per trattare l’osteoartrosi) funziona meglio per alleviare i sintomi nelle persone con osteoartrosi del ginocchio rispetto all’uso solo di paracetamolo.
Quindi, la combinazione di questi due trattamenti sembra essere più efficace nell’aiutare i pazienti a gestire i sintomi dell’artrosi del ginocchio [21].
tipo III

Scoperto nel 1971, il collagene di tipo III è uno dei principali componenti della famiglia del collagene, costituendo circa il 5-20% del contenuto totale di collagene nel nostro corpo. È come un elemento fondamentale che contribuisce all'integrità strutturale [22].
Il collagene di tipo III è anche chiamato catena alfa-1 (III) del collagene o catena alfa 1 del collagene di tipo III [23] (ricordate che abbiamo menzionato che le catene alfa sono le singole “corde” che compongono la struttura a tripla elica del collagene).
Il collagene di tipo III è una proteina codificata dal gene COL3A1 negli esseri umani (ciò significa che il gene istruisce l'organismo a produrre collagene di tipo III) [23].
Si trova in quantità significative nei grandi vasi sanguigni, nell’utero e nell’intestino e funge da componente strutturale, fornendo essenzialmente un’impalcatura per questi organi cavi.
Ma la sua importanza va oltre la struttura. Interagisce con le piastrine del nostro sangue, favorendo il processo di coagulazione e agisce anche come molecola di segnalazione durante la guarigione delle ferite.
Il significato del collagene di tipo III diventa ancora più chiaro quando si studiano individui con mutazioni nel gene COL3A1.
Queste mutazioni possono portare a problemi seri come rotture spontanee delle arterie, dell’utero e dell’intestino.
Ciò evidenzia il ruolo indispensabile del collagene di tipo III nel mantenere questi organi strutturalmente intatti [24, 25, 26].
È interessante notare che le mutazioni nel gene COL3A1 possono anche provocare gravi anomalie cerebrali. Ciò suggerisce che il collagene di tipo III non riguarda solo la struttura fisica.
È anche fondamentale per il normale sviluppo del cervello [27, 28, 29].
Quindi, oltre ad essere una centrale elettrica strutturale, il collagene di tipo III svolge un ruolo vitale in tutto il nostro corpo, influenzando sia la struttura fisica che i processi funzionali.
Tipo IV
Il collagene di tipo IV è una proteina distribuita su più tessuti, specialmente in un'area chiamata membrana basale.
Può essere trovato in vari punti del corpo, come i capelli, le superfici cellulari e la placenta [30].
Ciò che rende interessante il collagene di tipo IV è la sua struttura. Alla fine della sua catena (C-terminale), c'è qualcosa chiamato dominio C4 e, a differenza di altri collageni, non viene rimosso durante il processo di produzione delle proteine.
Questa caratteristica unica fa sì che le fibre di collagene si colleghino testa a testa invece che fianco a fianco [30].
Il collagene di tipo IV non ha un amminoacido specifico (glicina) in ogni terza posizione della sua catena, cosa tipica di altri tipi di collagene.
Questa assenza rende il collagene di tipo IV più flessibile e curvo nella sua forma complessiva rispetto ad altre varietà di collagene [31].
A causa di queste caratteristiche strutturali, il collagene di tipo IV ha una capacità speciale: può formare fogli. Questi fogli costituiscono una parte significativa della composizione strutturale della membrana basale della pelle.
Ciò significa che il collagene di tipo IV ha una struttura distinta che gli consente di creare fogli flessibili e curvi e lo troverai a svolgere un ruolo chiave nella struttura della membrana basale della pelle [32, 33].
Tipo V
Il collagene di tipo V è come un collagene “manager” che aiuta a regolare la formazione delle fibrille (che sono come fili di collagene).
È disponibile in almeno tre diverse versioni: α1(V)2 α2(V), α1(V)3 e α1(V)α2(V)α3(V). Queste versioni sono realizzate combinando tre diverse catene alfa: α1(V), α2(V) e α3(V) [34].
Il collagene di tipo V non è il protagonista nella storia della matrice extracellulare; è più come un attore non protagonista. Si collega con altri collageni come il collagene di tipo I, formando queste fibrille miste o fili sottili con caratteristiche distinte [35].
Le cellule in varie parti del nostro corpo producono collagene di tipo V e la sua produzione è influenzata da elementi come il TGF-β (fattore di crescita beta trasformante) e altri fattori di crescita [36].
Anche se può resistere alla digestione da parte di alcuni enzimi [37], non è invincibile: le metalloproteinasi e le gelatinasi (alcuni enzimi presenti nel corpo) possono scomporlo, aiutando nel rimodellamento (costruzione) della matrice extracellulare [38].
Il collagene di tipo V è come un giocatore di squadra. Interagisce con altri tipi di collagene e proteine strutturali, rafforzando l'impalcatura nei nostri tessuti.
Interagisce anche con le macromolecole della matrice, influenzando il modo in cui le cellule si comportano e funzionano nel nostro corpo [37]. Il collagene di tipo V svolge un ruolo cruciale nel mantenimento della struttura e della funzione dei nostri tessuti.
Tipo VI
Il collagene VI svolge vari ruoli nei tessuti in cui si trova, svolgendo funzioni meccaniche, proteggendo le cellule inibendo l'apoptosi (morte cellulare programmata) e proteggendole dal danno ossidativo.
Contribuisce inoltre allo sviluppo e alla progressione del tumore influenzando la differenziazione cellulare e i meccanismi autofagici [39].
Questo tipo di collagene svolge un ruolo nell'ancoraggio di cellule e tessuti, contribuendo alla stabilità complessiva della matrice extracellulare.
Tipo VII
Il collagene di tipo VII ha preso il nome perché, all'inizio, la gente pensava che fosse una molecola extra lunga, quindi lo chiamavano collagene a catena lunga.
Questo collagene è importante per formare fibrille di ancoraggio, che sono come travi di supporto che forniscono stabilità al modo in cui lo strato esterno della pelle (epidermide) aderisce allo strato più profondo (derma) in un'interfaccia specifica chiamata lamina lucida/derma papillare [40].
Tipo VIII
Il collagene di tipo VIII è prodotto da diversi tipi di cellule, tra cui le cellule endoteliali (quelle che rivestono i vasi sanguigni), i cheratinociti (cellule nello strato esterno della pelle), i mastociti (un tipo di cellula immunitaria), le cellule endoteliali microvascolari (minuscoli vasi sanguigni) e persino alcune cellule tumorali.
Lo puoi trovare in diverse matrici extracellulari, come nella parte bianca dell'occhio (sclera), nella pelle e nei minuscoli filtri nei reni (glomerulo) [6, 41].
Per quanto riguarda la sua struttura, il collagene di tipo VIII è costituito da due catene alfa, in particolare [alfa 1(VIII)2 alfa 2(VIII)] [42].
Il suo ruolo nell'organismo è ancora sconosciuto, anche se studi recenti suggeriscono che sia relativamente importante nei vasi sanguigni.
Alcune ricerche indicano che potrebbe svolgere un ruolo nel movimento delle cellule muscolari lisce, che è fondamentale per il mantenimento della struttura dei vasi sanguigni.
I ricercatori ipotizzano che il collagene di tipo VIII possa agire come una sorta di fondamento per varie cellule, aiutando le cellule endoteliali a muoversi durante la formazione di nuovi vasi sanguigni (angiogenesi), aiutando le cellule muscolari lisce a penetrare nello strato interno dei vasi sanguigni (invasione intimale) e assistere i miofibroblasti durante la cicatrizzazione dei tessuti (condizioni fibrotiche) [43].
Digita X
Il collagene di tipo X è un membro speciale della famiglia del collagene a catena corta, presente principalmente nella cartilagine e fondamentale per la crescita e lo sviluppo delle ossa.
Si trova principalmente nelle placche di crescita delle ossa, dove avviene la formazione di nuovo osso durante lo sviluppo e la crescita.
La funzione primaria del collagene di tipo X è contribuire allo sviluppo e alla mineralizzazione delle ossa, in particolare nelle placche di crescita.
È come un marcatore per un tipo specifico di cellule cartilaginee mature chiamate "condrociti ipertrofici" [44]. Negli esseri umani, fino al 18% della sintesi del collagene in alcune regioni può essere di tipo X.
Si ritiene che il suo ruolo aiuti nel processo di calcificazione, influenzando potenzialmente l'organizzazione della matrice cartilaginea.
I ricercatori ritengono che il collagene di tipo X sia vitale per comprendere la crescita e la differenziazione dei condrociti. Le mutazioni in questo tipo di collagene potrebbero essere collegate ad alcuni disturbi dello sviluppo osseo [45].
Nel complesso, il collagene di tipo X fornisce una prospettiva sulla biologia della cartilagine, aiutando i ricercatori a saperne di più sulla crescita e sullo sviluppo delle ossa.
Tipo XI
Il collagene di tipo XI svolge un ruolo nella struttura strutturale del corpo.
Agendo come un collagene fibrillare, è diffuso in vari tessuti come la cartilagine articolare, i testicoli, i tendini, le ossa, i muscoli, la placenta, i polmoni e persino il neoepitelio del cervello.
Il suo compito è regolare la fibrillogenesi, che aiuta a formare fibrille di collagene, quelle strutture filiformi che tengono insieme i nostri tessuti [46].
Una delle sue funzioni è mantenere la spaziatura e il diametro delle fibrille di collagene di tipo II, agendo come supervisore della loro corretta formazione. Svolge anche un ruolo nell'avviare la formazione del collagene di tipo I e II [46].
Può legarsi con sostanze come eparina, eparan solfato e dermatan solfato. Tuttavia, nonostante la sua potenziale importanza, attualmente disponiamo di biomarcatori specifici per misurare il collagene di tipo XI [47].
Tipi XII, XIV e XVI
Il collagene di tipo XII è come il supervisore in alcune parti del nostro corpo – si trova principalmente nel pericondrio (uno strato attorno alla cartilagine) e sulla superficie articolare.
È una molecola “omotrimerica”, nel senso che è composta da tre parti identiche. Immaginatelo come una grande struttura a forma di croce con domini specifici che raggiungono lo spazio attorno alle fibrille di collagene.
Questo collagene ha due forme: una più piccola che si trova nella pelle e simili e una più grande che si trova nelle cellule epidermiche [48].
Ora parliamo del collagene di tipo XIV. È simile ma con una struttura a forma di croce più piccola. Il collagene di tipo XIV è distribuito in modo più uniforme in vari tessuti, interagendo con il collagene di tipo I in luoghi come pelle, tendini e altro. Non si lega direttamente al collagene di tipo I ma piuttosto ad una sostanza chiamata decorina [48].
Infine abbiamo il collagene di tipo XVI, sintetizzato dai fibroblasti e dai mioblasti. Fa parte dello spettacolo nella matrice territoriale dei condrociti, quelle cellule della cartilagine.
Immaginatelo come questo giocatore integrato in sottili fibrille di collagene, che frequenta il collagene di tipo II e XI.
È come una troupe dietro le quinte in diverse parti del nostro corpo, che si assicura che le cose siano strutturate nel modo giusto [48].
Hai bisogno di tutti i tipi di collagene?

Per costruire il collagene nel corpo, è necessario disporre degli elementi costitutivi del collagene: gli aminoacidi includono glicina, prolina, lisina, idrossilisina e idrossiprolina [49].
Inoltre, hai bisogno della vitamina C per aiutare a formare il collagene nel corpo. La vitamina C è importante per i tessuti connettivi perché consente a un enzima chiamato prolil 4-idrossilasi di svolgere il suo lavoro.
Questo enzima è necessario per modificare la prolina, un elemento costitutivo delle proteine, e aiuta a produrre e rilasciare il procollagene.
Non è necessario assumere tutti i tipi di collagene purché si assumano abbastanza elementi costitutivi – ad esempio amminoacidi – di cui è composto il collagene.
Gli integratori di collagene e persino la gelatina vengono tutti scomposti in glicina, prolina, lisina, idrossilisina e idrossiprolina e possono essere utilizzati per costruire i vari tipi di collagene nel corpo.
La fonte di collagene è importante?
Le proteine del collagene di origine animale potrebbero non essere adatte agli atleti vegetariani o vegani.
Sebbene esistano prodotti vegani e vegetariani progettati per replicare il collagene di origine animale se si dimostrasse che i peptidi unici delle proteine animali possiedono un’attività biologica distinta, le alternative vegetariane e vegane potrebbero essere considerate meno efficienti.
Sono necessarie ulteriori ricerche per valutare la disponibilità di aminoacidi e l’efficacia dei sostituti vegani del collagene.
Varie fonti di collagene di origine animale presentano lievi variazioni nel contenuto di aminoacidi, ma le differenze non sono abbastanza significative da dichiarare un tipo superiore a un altro.
Tabella 1: Composizione aminoacidica dei 5 principali collageni e gelatina dei mammiferi [50]
| Amminoacido | Gelatina animale | |||||||
| Pelle di bue | Osso commerciale | Pelle di maiale | Ox-bone | Pelle di squalo | Pelle di pesce polmonare | Bone | tendine | |
| Glycine | 27.5 | 27.2 | 26.4 | 25.3 | 26.5 | 24 | 25.8 | 25.4 |
| Leucina | 3.3 | 3.5 | 3.3 | 3.9 | 3.5 | 2.8 | 3.6 | 3.6 |
| Proline | 16.4 | 15.5 | 16.2 | 14.7 | 13.9 | 15.8 | 15.3 | 15.2 |
| idrossiprolina | 14.1 | 13.3 | 13.5 | 14.1 | 10.9 | 10.8 | 14.1 | 12.6 |
| hydroxylysine | 1.0 | 0.7 | 1.0 | 1.1 | 0.8 | 1.1 | 0.6 | |
Il miglior tipo di collagene
Il dibattito sulla superiorità dei tipi di collagene rimane instabile a causa dei loro profili aminoacidici simili. Il collagene di tipo I emerge come una scelta strategica dato il suo ruolo cruciale nel rinforzare ossa, muscoli e tessuti connettivi.
L’attenzione dovrebbe essere posta su un ampio apporto di aminoacidi per il supporto complessivo del collagene. Ma per benefici mirati, orientarsi verso il collagene di tipo I potrebbe essere la soluzione migliore.
Riferimenti
- Abreu-Velez, AM e Howard, MS (2012). Collagene IV nella pelle normale e nei processi patologici. N Am J Med Sci, 4(1), 1-8. doi:10.4103/1947-2714.92892
- Adam, MP, Feldman, J., Mirzaa, GM, Pagon, RA, Wallace, SE, Bean, LJ, . . . Amemiya, A. (1993). GeneReviews®[Internet].
- Alcaide-Ruggiero, L., Molina-Hernández, V., Granados, MM, & Domínguez, JM (2021). Tipi principali e minori di collageni nella cartilagine articolare: il ruolo dei collageni nella valutazione dei tessuti riparativi nei difetti condrali. Int J Mol Sci, 22(24). doi:10.3390/ijms222413329
- Aycock, RS e Seyer, JM (1989). Collageni di fegato umano normale e cirrotico. Ricerca sul tessuto connettivo, 23(1), 19-31.
- Baar, K. (2017). Minimizzare gli infortuni e massimizzare il ritorno al gioco: lezioni dai legamenti ingegnerizzati. Medicina sportiva, 47(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
- Bakilan, F., Armagan, O., Ozgen, M., Tascioglu, F., Bolluk, O., & Alatas, O. (2016). Effetti del trattamento con collagene nativo di tipo II sull'osteoartrosi del ginocchio: uno studio controllato randomizzato. Eurasiatico J Med, 48 anni(2), 95-101. doi:10.5152/eurasianjmed.2015.15030
- Birk, DE (2001). Collagene di tipo V: interazioni eterotipiche del collagene di tipo I/V nella regolazione dell'assemblaggio delle fibrille. Micron, 32(3), 223-237.
- Byers, PH, Belmont, J., Black, J., De Backer, J., Frank, M., Jeunemaitre, X., . . . Sanders, L. (2017). Diagnosi, storia naturale e gestione della sindrome vascolare di Ehlers-Danlos. Articolo presentato all'American Journal of Medical Genetics Part C: Seminars in Medical Genetics.
- Cao, Q., Mak, KM e Lieber, CS (2002). La DLPC diminuisce l'mRNA del collagene indotto dal TGF-β1 inibendo la MAPK p38 nelle cellule stellate epatiche. American Journal of Physiology-Fisiologia gastrointestinale e epatica, 283(5), G1051-G1061.
- Chung, HJ e Uitto, J. (2010). Collagene di tipo VII: la proteina di ancoraggio della fibrilla responsabile dell'epidermolisi bollosa distrofica. Dermatol Clinic, 28(1), 93-105. doi:10.1016/j.det.2009.10.011
- Clifford, T., Ventress, M., Allerton, DM, Stansfield, S., Tang, JCY, Fraser, WD, . . . Stevenson, E. (2019). Gli effetti dei peptidi di collagene sul danno muscolare, sull'infiammazione e sul turnover osseo dopo l'esercizio: uno studio randomizzato e controllato. Aminoacidi, 51(4), 691-704. doi:10.1007/s00726-019-02706-5
- Di Martino, A., Cescon, M., D'Agostino, C., Schilardi, F., Sabatelli, P., Merlini, L., & Faldini, C. (2023). Collagene VI nel sistema muscolo-scheletrico. Int J Mol Sci, 24(6). doi:10.3390/ijms24065095
- Dong, C. e Lv, Y. (2016). Applicazione dell'impalcatura di collagene nell'ingegneria dei tessuti: recenti progressi e nuove prospettive. Polimeri (Basilea), 8(2). doi:10.3390/polym8020042
- Ellingson, AJ, Pancheri, NM e Schiele, NR (2022). Regolatori della reticolazione del collagene nei tendini in via di sviluppo e adulti. Eur Cell Mater, 43, 130-152. doi:10.22203/eCM.v043a11
- Frantz, C., Stewart, KM e Weaver, VM (2010). La matrice extracellulare in uno sguardo. J Cell Sci, 123(Pt 24), 4195-4200. doi:10.1242/jcs.023820
- Hasegawa, H., Naito, I., Nakano, K., Momota, R., Nishida, K., Taguchi, T., . . . Ohtsuka, A. (2007). Le distribuzioni delle catene α del collagene di tipo IV nelle membrane basali dell'epidermide umana e degli annessi cutanei. Archivi di istologia e citologia, 70(4), 255-265.
- Holwerda, AM e van Loon, LJC (2022). L'impatto dell'ingestione di proteine di collagene sul rimodellamento del tessuto connettivo muscoloscheletrico: una revisione narrativa. Nutr Rev, 80(6), 1497-1514. doi:10.1093/nutrit/nuab083
- Horn D., Siebert E., Seidel U., Rost I., Mayer K., Abou Jamra R., . . . Kornak, Stati Uniti (2017). Le mutazioni bialleliche di COL3A1 determinano uno spettro clinico di specifiche anomalie strutturali del cervello e anomalie del tessuto connettivo. Giornale americano di genetica medica Parte A, 173(9), 2534-2538.
- Jørgensen, A., Fagerheim, T., Rand-Hendriksen, S., Lunde, PI, Vorren, TO, Pepin, MG, . . . Byers, PH (2015). Sindrome vascolare di Ehlers-Danlos in fratelli con varianti bialleliche della sequenza COL3A1 e marcata variabilità clinica nella famiglia allargata. Giornale europeo di genetica umana, 23(6), 796-802.
- Kannus, P. (2000). Struttura del tessuto connettivo tendineo. Scand J Med Sci Sport, 10(6), 312-320. doi:10.1034/j.1600-0838.2000.010006312.x
- Kapandji, I. (1977). La fisiologia delle articolazioni. Churchill Livingstone, 2, 186-189.
- Khoshnoodi, J., Pedchenko, V., & Hudson, BG (2008). Collagene IV dei mammiferi. Microsc ResTech, 71(5), 357-370. doi:10.1002/jemt.20564
- Konomi, H., Hayashi, T., Nakayasu, K., & Arima, M. (1984). Localizzazione del collagene di tipo V e del collagene di tipo IV nella cornea, nel polmone e nella pelle umana. Evidenza immunoistochimica mediante anticorpi anti-collagene caratterizzati da immunoelettroblotting. Il giornale americano di patologia, 116(3), 417.
- Kuivaniemi, H. e Tromp, G. (2019). Collagene di tipo III (COL3A1): struttura genica e proteica, distribuzione tissutale e malattie associate. Gene, 707, 151-171. doi:10.1016/j.gene.2019.05.003
- Lian, C., Wang, X., Qiu, X., Wu, Z., Gao, B., Liu, L., . . . Peng, Y. (2019). Il collagene di tipo II sopprime l’ipertrofia dei condrociti articolari e la progressione dell’osteoartrosi promuovendo l’interazione dell’integrina β1-SMAD1. Ricerca sulle ossa, 7(1), 8.
- Luo, YY e Karsdal, MA (2016). Capitolo 11 – Collagene di tipo XI. In MA Karsdal (a cura di), Biochimica dei collageni, delle laminine e dell'elastina (pp. 77-80): Stampa accademica.
- Mak, KM, Png, CY e Lee, DJ (2016). Collagene di tipo V in salute, malattia e fibrosi. Anat Rec (Hoboken), 299(5), 613-629. doi:10.1002/ar.23330
- Malfait, F., Francomano, C., Byers, P., Belmont, J., Berglund, B., Black, J., . . . Burrows, NP (2017). La classificazione internazionale 2017 delle sindromi di Ehlers-Danlos. Articolo presentato all'American Journal of Medical Genetics Part C: Seminars in Medical Genetics.
- Miller, EJ, Epstein Jr, EH e Piez, KA (1971). Identificazione di tre collageni geneticamente distinti mediante scissione con bromuro di cianogeno della pelle umana insolubile e del collagene cartilagineo. Comunicazioni di ricerca biochimica e biofisica, 42(6), 1024-1029.
- Moriya, K., Bae, E., Honda, K., Sakai, K., Sakaguchi, T., Tsujimoto, I., . . . Sakai, T. (2011). Un meccanismo indipendente dalla fibronectina della fibrillogenesi del collagene nel rimodellamento del fegato adulto. Gastroenterologia, 140(5), 1653-1663.
- Muragaki, Y., Jacenko, O., Apte, S., Mattei, M., Ninomiya, Y., & Olsen, BR (1991). Il gene del collagene alfa 2 (VIII). Un nuovo membro della famiglia del collagene a catena corta situato sul cromosoma umano 1. Giornale di chimica biologica, 266(12), 7721-7727.
- Myllyharju, J. e Kivirikko, KI (2004). Collageni, enzimi modificanti e loro mutazioni negli esseri umani, nelle mosche e nei vermi. TENDENZE in genetica, 20(1), 33-43.
- Nah, HD, Swoboda, B., Birk, DE, & Kirsch, T. (2001). Procollagene di tipo IIA: espressione nello sviluppo della cartilagine degli arti di pollo e della cartilagine articolare osteoartritica umana. Dinamiche dello sviluppo: una pubblicazione ufficiale dell'American Association of Anatomists, 220(4), 307-322.
- Naomi, R., Ridzuan, PM e Bahari, H. (2021). Approfondimenti attuali sul collagene di tipo I. Polimeri (Basilea), 13(16). doi:10.3390/polym13162642
- Olsen, BR (1995). Nuove intuizioni sulla funzione del collagene dall’analisi genetica. Opinione attuale in biologia cellulare, 7(5), 720-727.
- Patel, K., Munir, D., & Santos, R. (2022). Uso vantaggioso delle pelli animali per la gestione dei rifiuti di macellazione e conceria: una rassegna di approcci non convenzionali, innovativi e sostenibili. Scienze ambientali e ricerca sull'inquinamento, 29. doi:10.1007/s11356-021-17101-5
- Plancke, A., Holder-Espinasse, M., Rigau, V., Manouvrier, S., Claustres, M., & Van Kien, PK (2009). L'omozigosi per un allele nullo di COL3A1 provoca la sindrome recessiva di Ehlers-Danlos. Giornale europeo di genetica umana, 17(11), 1411-1416.
- Plenz, GA, Deng, MC, Robenek, H., & Völker, W. (2003). Collageni vascolari: riflettori sul ruolo del collagene di tipo VIII nell'aterogenesi. Aterosclerosi, 166(1), 1-11.
- Ricard-Blum, S. (2011). La famiglia del collagene. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
- Schmid,TM e Linsenmayer,TF (1990). Microscopia immunoelettronica del collagene di tipo X: forme supramolecolari all'interno della cartilagine embrionale di pulcino. Dev Biol, 138(1), 53-62. doi:10.1016/0012-1606(90)90176-j
- Shen, G. (2005). Il ruolo del collagene di tipo X nel facilitare e regolare l'ossificazione endocondrale della cartilagine articolare. Orthod Craniofac Res, 8(1), 11-17. doi:10.1111/j.1601-6343.2004.00308.x
- Shuttleworth, California (1997). Collagene di tipo VIII. Int J Biochem Cell Biol, 29(10), 1145-1148. doi:10.1016/s1357-2725(97)00033-2
- Smith, SM e Melrose, J. (2019). Le interazioni collagene-perlecano-HS di tipo XI stabilizzano la matrice pericellulare delle cellule fibrose dell'anello e dei condrociti fornendo stabilizzazione della matrice e omeostasi. Giornale di istologia molecolare, 50(3), 285-294. doi:10.1007/s10735-019-09823-1
- Söderhäll, C., Marenholz, I., Kerscher, T., Rüschendorf, F., Esparza-Gordillo, J., Worm, M., . . . Rohde, K. (2007). Le varianti in un nuovo gene del collagene epidermico (COL29A1) sono associate alla dermatite atopica. Biologia PLoS, 5(9), e242.
- Sorushanova, A., Delgado, LM, Wu, Z., Shologu, N., Kshirsagar, A., Raghunath, R., . . . Zeugolis, DI (2019). La superfamiglia del collagene: dalla biosintesi allo sviluppo avanzato di biomateriali. Avv. Mater, 31(1), e1801651. doi:10.1002/adma.201801651
- Uzawa, K., Kasamatsu, A., & Yamauchi, M. (2023). Reticolazione del collagene nel cancro orale. Scienza orale internazionale, 21. doi:10.1002/osi2.1182
- van der Rest, M., & Garrone, R. (1991). Famiglia di proteine del collagene. Faseb j, 5(13), 2814-2823.
- Von Der Mark, K. (2006). CAPITOLO 1 – Struttura, biosintesi e regolazione genica dei collageni nella cartilagine e nell'osso. In MJ Seibel, SP Robins e JP Bilezikian (a cura di), Dinamica del metabolismo osseo e cartilagineo (seconda edizione) (pagg. 3-40). Burlington: Stampa accademica.
- Wolff, K., Goldsmith, LA, Katz, SI, Gilchrest, BA, Paller, AS e Leffell, DJ (2008). La dermatologia di Fitzpatrick in medicina generale: McGraw-Hill New York.
- YANG, CL, RUI, H., MOSLER, S., NOTBOHM, H., SAWARYN, A., & MÜLLER, PK (1993). Collagene II dalla cartilagine articolare e dall'anello fibroso: implicazioni strutturali e funzionali delle modifiche post-traduzionali specifiche del tessuto delle molecole di collagene. Giornale europeo di biochimica, 213(3), 1297-1302.
