O colágeno é uma proteína que pode ajudar no tratamento de dores nas articulações e na recuperação dos tecidos moles. Porém, existem muitos suplementos no mercado, e você já deve ter notado diferentes tipos de colágeno, por exemplo, colágeno I, II, II, IV… e assim por diante.
Embora os diferentes tipos de colágeno tenham funções distintas e essenciais no corpo, você não precisa tomar suplementos separados para construir esses colágenos, pois todos são compostos pelos mesmos aminoácidos: glicina, prolina e hidroxiprolina. Contanto que você obtenha quantidades suficientes desses aminoácidos no momento certo (60 a 90 minutos antes do treino) com uma fonte de vitamina C, seu corpo poderá produzir os diferentes tipos de colágeno necessários.
No entanto, é bom entender o que os diferentes tipos de colágeno fazem no corpo, por que você precisa ingerir colágeno suficiente e como interpretar os diferentes rótulos dos suplementos.
Conteúdo
O que é colágeno?
O colágeno é uma parte vital da estrutura dos tecidos que lhes confere flexibilidade. Nos músculos, o tecido conjuntivo ajuda a transmitir a força das contrações musculares aos tendões e ossos.
As proteínas do tecido conjuntivo estão em constante mudança e podem se adaptar. Comer proteínas aumenta a síntese de proteínas musculares.
Proteínas de alta qualidade e fáceis de digerir são geralmente recomendadas para obter melhores resultados. Curiosamente, estudos recentes mostram que a ingestão de proteínas não aumenta a produção de proteínas no tecido conjuntivo muscular.
Esta falta de aumento pode ser devida à insuficiência de glicina e/ou prolina. Sugere-se que alimentos ricos em colágeno contendo bastante glicina e prolina forneçam os blocos de construção para a síntese de proteínas do tecido conjuntivo. [1].
No corpo, o colágeno é como a estrutura que mantém tudo unido. Imagine-o como o alicerce essencial que mantém a saúde da nossa pele e tecidos conjuntivos [2].
“Tecido conjuntivo” é a estrutura de suporte que une nossos órgãos e tecidos. É composto por fibroblastos e sua matriz extracelular, uma espécie de andaime ao redor das células.
Esta matriz extracelular é vital porque garante que as células se unam, mantém a estabilidade e auxilia no processo de regeneração em diferentes tecidos. [3].
Esses tecidos precisam de colágeno para permanecerem fortes, flexíveis e capazes de se repararem. O colágeno faz parte da matriz extracelular, que é como uma rede de suporte para nossas células [4].
Esta matriz fornece estrutura e ajuda a regular e renovar os nossos tecidos.
Pense nos tendões, as faixas resistentes que conectam os músculos aos ossos. Eles dependem fortemente de colágeno, que representa uma parte significativa de seu peso.
A estrutura única do colágeno, formada por aminoácidos específicos como glicina e prolina, confere-lhe força. Isto é particularmente importante para que os tendões possam suportar tensões e forças, como as encontradas durante atividades desportivas, ajudando a mantê-los saudáveis e reduzindo o risco de lesões. [5].
Portanto, o colágeno não é apenas uma proteína; é um elemento crucial que mantém a integridade estrutural do nosso corpo sob controle.
O colágeno forma uma “hélice tripla”, que o ajuda a ser forte e flexível. A hélice tripla consiste em três cadeias polipeptídicas, ou filamentos de proteínas, entrelaçadas como uma corda.
Essas cadeias são ricas em aminoácidos, sendo a glicina a mais abundante. A prolina e a hidroxiprolina também são cruciais para estabilizar a estrutura [2, 6].
Esta combinação de força e flexibilidade torna o colágeno adequado para fornecer suporte estrutural em tecidos como pele, tendões e ossos.
Você deve tomar um tipo específico de colágeno?

O colágeno tipo I é predominante nos ossos, músculos e tecido conjuntivo. Ainda não há pesquisas suficientes para afirmar que o consumo de colágeno tipo I é superior ao consumo de outros tipos de colágeno, como o tipo II ou III, porque todos contêm blocos de construção semelhantes – ou seja, aminoácidos.
Curiosamente, muitos estudos também usam gelatina como fonte de colágeno ao estudar o impacto do colágeno no corpo.
Enfatizando mais uma vez que a principal prioridade é obter os diferentes aminoácidos que podem formar os diversos tipos de colágeno.
No entanto, como o colágeno tipo I desempenha um papel tão significativo nos ossos, músculos e tecidos conjuntivos, faz sentido optar por ele ao escolher um suplemento de colágeno.
Diferentes tipos de colágeno
Existem um total de 29, cada um designado por algarismos romanos I-XXIX na ordem de sua descoberta [7, 8]. Cada tipo de colágeno tem características, funções e localizações únicas no corpo [2].
Diferentes tipos de colágeno têm diferenças estruturais que os ajudam a desempenhar funções corporais diferentes em locais diferentes.
Sua composição e disposição de aminoácidos determinam a estrutura física do colágeno e como as moléculas individuais de colágeno interagem para formar estruturas maiores. [2, 5, 9].
Veja como a estrutura física está relacionada à diversidade de tipos de colágeno:
- Composição de aminoácidos:
A composição de aminoácidos do colágeno varia entre os diferentes tipos. Por exemplo, os tipos de colágeno I e II têm alto teor de glicina, prolina e hidroxiprolina, enquanto outros tipos podem ter diferentes composições de aminoácidos. Esta variação influencia a força, flexibilidade e estabilidade da estrutura do colágeno [9].
- Estrutura de Hélice Tripla:
A “hélice tripla” refere-se à forma como o colágeno é formado. Cada estrutura consiste em três cadeias polipeptídicas torcidas umas nas outras, quase como uma corda.
Cada uma dessas cadeias é conhecida como alfa cadeia (lembre-se disso porque nos referiremos a ela mais adiante neste post). O tipo específico de colágeno é determinado pelo arranjo dessas cadeias alfa e pelas características da estrutura de colágeno resultante.
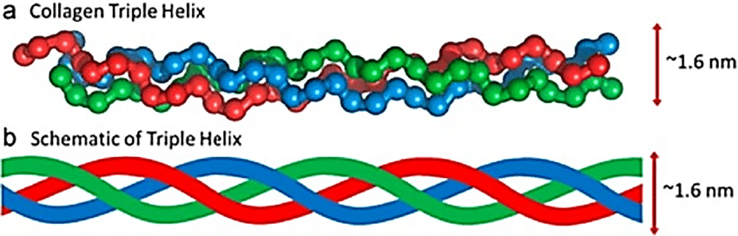
Figura 1: A estrutura da tripla hélice do colágeno [10]
- Formação de Fibrilas:
As moléculas de colágeno se agrupam em estruturas maiores, como fibrilas e fibras [2, 9].
“Fibrilas” referem-se a estruturas minúsculas, semelhantes a fios, menores que fibras, mas maiores que moléculas individuais. Imagine-os como fios ou fios em miniatura que formam uma estrutura maior. No contexto do colágeno, as fibrilas são os blocos de construção das fibras de colágeno.
Imagine uma corda feita de vários pequenos fios torcidos juntos. Cada um desses fios pode ser comparado a uma fibrila.
Estas fibrilas unem forças para criar uma estrutura mais significativa e mais forte, semelhante à forma como os fios de uma corda se combinam para formar um cordão robusto e durável.
A forma como essas estruturas se formam e as interações entre as moléculas de colágeno influenciam as propriedades físicas dos tecidos.
- Reticulação:
As fibras de colágeno são estabilizadas por ligações cruzadas e químicas entre moléculas de colágeno adjacentes. O padrão e a extensão da reticulação contribuem para a força e resiliência dos tecidos ricos em colágeno, como visto na Figura 2.
Diferentes tipos de colágeno podem apresentar variações nos padrões de reticulação, afetando as características físicas dos tecidos [11].
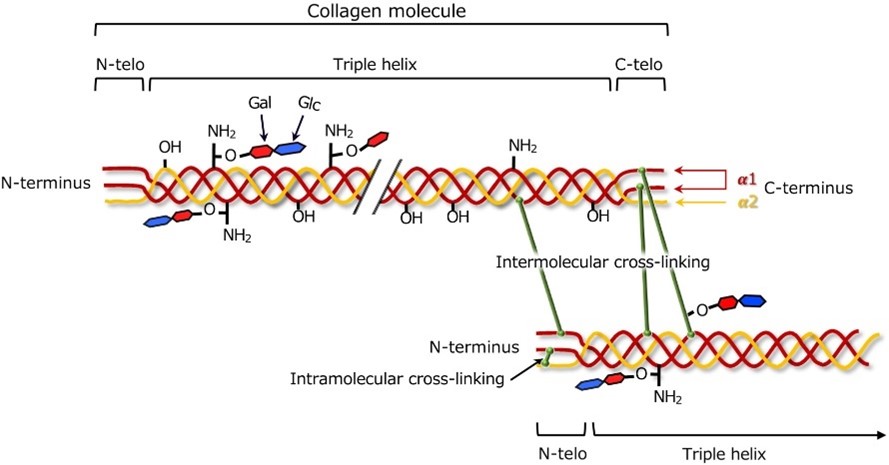
Figura 2: Reticulação de colágeno [12]
Com base na forma como são constituídos nos tecidos, os colágenos são geneticamente diferentes e classificados em subgrupos [13].
Colágenos como I, II, III, V e X se unem para criar grandes fibrilas fora das células, o que lhes valeu o nome de colágenos formadores de fibrilas.
O colágeno tipo IV, por outro lado, forma uma rede entrecruzada nas membranas basais. Depois, há o colágeno tipo VI, que produz microfibrilas exclusivas, e o colágeno tipo VII, que cria fibrilas de ancoragem.
Um grupo chamado colágenos FACIT [14] (colágenos associados a fibrilas com hélices triplas interrompidas), incluindo os tipos IX, XII, XIV, XIX, XX e XXI, unem-se às fibras colágenas maiores, agindo como pontes moleculares.
A sua função é manter a matriz extracelular organizada e estável. É como se eles fossem a equipe de apoio garantindo que tudo permanecesse no lugar.
tipo I

O colágeno tipo I é um bloco de construção crucial encontrado em nossos ossos, pele e tecidos conjuntivos [15]. Não é apenas o tipo de colágeno mais abundante, mas também desempenha um papel vital na manutenção da estrutura e da força desses tecidos.
Pense nele como o arquiteto principal, formando a estrutura básica para diversas partes do nosso corpo. Os cientistas estudaram extensivamente o colágeno tipo I devido à sua importância, tornando-o o tipo de colágeno mais investigado.
É um componente fundamental em quase todos os tecidos conjuntivos, formando a estrutura primária da membrana intersticial que suporta e mantém o nosso corpo unido.
Além do seu significado estrutural, O colágeno tipo I encontra aplicações em diversos cenários médicos, incluindo procedimentos cirúrgicos, cicatrização de feridas e engenharia de tecidos [16], mostrando sua versatilidade e importância na promoção da saúde e recuperação.
tipo II
Deixe-me quebrar isto para você: O colágeno tipo II é o principal ingrediente na estrutura da cartilagem, que é o material que amortece e sustenta as articulações.
Cerca de 90% do colágeno da cartilagem é colágeno tipo II [17].
As características únicas do colágeno Tipo II tornam-no essencial para a resiliência e as propriedades de absorção de choque da cartilagem, o que é crucial para a saúde das articulações.
O colágeno tipo 2 cria uma rede de pequenas fibras necessárias para a resistência da cartilagem [18, 19].
O colágeno tipo II também desempenha um papel importante no crescimento e nas alterações das células (chamadas condrócitos) no desenvolvimento normal da cartilagem e quando alguém tem osteoartrite (OA), uma condição que afeta as articulações.
Quando o colágeno tipo II é perdido, pode acelerar o crescimento dos condrócitos e a progressão da osteoartrite.
Isso acontece através de algo chamado caminho BMP-SMAD1, que é como um sistema de comunicação dentro das células.
Então, em poucas palavras, ter colágeno tipo II suficiente é essencial para manter a cartilagem saudável e prevenir o agravamento da osteoartrite. [20].
Um estudo realizado em 2016 mostrou que o uso conjunto de colágeno tipo II nativo e paracetamol (um tipo de medicamento usado para tratar a osteoartrite) funciona melhor para aliviar os sintomas em pessoas com osteoartrite de joelho do que usar apenas paracetamol.
Portanto, a combinação desses dois tratamentos parece ser mais eficaz para ajudar os pacientes a controlar os sintomas da osteoartrite do joelho. [21].
tipo III

Descoberto em 1971, o colágeno tipo III é um elemento importante na família do colágeno, constituindo cerca de 5–20% do conteúdo total de colágeno em nosso corpo. É como um alicerce fundamental que contribui para a integridade estrutural [22].
O colágeno tipo III também é chamado de cadeia de colágeno alfa-1 (III) ou cadeia alfa 1 de colágeno tipo III [23] (lembre-se de que mencionamos que as cadeias alfa são as “cordas” individuais que constituem a estrutura da tripla hélice do colágeno).
O colágeno tipo III é uma proteína codificada pelo gene COL3A1 em humanos (isso significa que o gene instrui o corpo a produzir colágeno tipo III) [23].
É encontrado em quantidades significativas nos grandes vasos sanguíneos, no útero e no intestino e serve como um componente estrutural, fornecendo essencialmente uma estrutura para esses órgãos ocos.
Mas a sua importância vai além da estrutura. Ele interage com as plaquetas do sangue, auxiliando no processo de coagulação, e também atua como uma molécula sinalizadora durante a cicatrização de feridas.
A importância do colágeno tipo III fica ainda mais clara quando se estudam indivíduos com mutações no gene COL3A1.
Essas mutações podem levar a problemas sérios, como rupturas espontâneas nas artérias, no útero e no intestino (seu intestino).
Isto destaca o papel indispensável do colágeno tipo III em manter estes órgãos estruturalmente intactos [24, 25, 26].
Curiosamente, mutações no gene COL3A1 também podem resultar em anomalias cerebrais graves. Isso sugere que o colágeno tipo III não se trata apenas de estrutura física.
Também é fundamental para o desenvolvimento normal do cérebro [27, 28, 29].
Assim, além de ser uma potência estrutural, o colágeno tipo III desempenha papéis vitais em todo o nosso corpo, influenciando tanto a estrutura física quanto os processos funcionais.
Tipo IV
O colágeno tipo IV é uma proteína distribuída por vários tecidos, especialmente em uma área chamada membrana basal.
Pode ser encontrado em vários locais do corpo, como cabelos, superfícies celulares e placenta. [30].
O que torna o colágeno Tipo IV interessante é a sua estrutura. No final da sua cadeia (terminal C), existe algo chamado domínio C4 e, ao contrário de outros colagénios, não é removido durante o processo de produção de proteínas.
Esta característica única faz com que as fibras de colágeno se unam lado a lado, em vez de lado a lado. [30].
O colágeno tipo IV não possui um aminoácido específico (glicina) em cada terceira posição de sua cadeia, o que é típico de outros tipos de colágeno.
Esta ausência torna o colágeno Tipo IV mais flexível e curvado em sua forma geral do que outras variedades de colágeno. [31].
Devido a estas características estruturais, o colagénio Tipo IV tem uma capacidade especial – pode formar folhas. Essas folhas são uma parte significativa da composição estrutural da membrana basal da pele.
Isso significa que o colágeno tipo IV tem uma estrutura distinta que lhe permite criar lâminas curvas e flexíveis, e você descobrirá que ele desempenha um papel fundamental na estrutura da membrana basal da pele. [32, 33].
Tipo V
O colágeno tipo V é como um colágeno “gerente” que ajuda a regular a formação de fibrilas (que são como fios de colágeno).
Ele vem em pelo menos três versões diferentes – α1(V)2 α2(V), α1(V)3 e α1(V)α2(V)α3(V). Essas versões são feitas combinando três cadeias alfa diferentes – α1(V), α2(V) e α3(V) [34].
O colágeno tipo V não é o personagem principal na história da matriz extracelular; é mais como um ator coadjuvante. Ele se liga a outros colágenos, como o colágeno tipo I, formando essas fibrilas mistas ou fios finos com características distintas. [35].
Células em várias partes do nosso corpo produzem colágeno tipo V, e sua produção é influenciada por fatores como TGF-β (fator transformador de crescimento beta) e outros fatores de crescimento. [36].
Mesmo que possa resistir à digestão por certas enzimas [37], não é invencível – metaloproteinases e gelatinases (certas enzimas do corpo) podem quebrá-lo, ajudando na remodelação (construção) da matriz extracelular [38].
O colágeno tipo V é como um jogador de equipe. Ele interage com outros tipos de colágeno e proteínas estruturais, fortalecendo a estrutura dos nossos tecidos.
Ele também interage com macromoléculas da matriz, influenciando o modo como as células se comportam e funcionam em nosso corpo. [37]. O colágeno tipo V desempenha um papel crucial na manutenção da estrutura e função dos nossos tecidos.
Tipo VI
O colágeno VI desempenha várias funções nos tecidos onde é encontrado, desempenhando funções mecânicas, protegendo as células ao inibir a apoptose (morte celular programada) e protegendo contra danos oxidativos.
Também contribui para o desenvolvimento e progressão do tumor, influenciando a diferenciação celular e os mecanismos autofágicos. [39].
Este tipo de colágeno desempenha um papel na ancoragem de células e tecidos, contribuindo para a estabilidade geral da matriz extracelular.
Tipo VII
O colágeno tipo VII recebeu esse nome porque, a princípio, as pessoas pensavam que era uma molécula extralonga, então o chamaram de colágeno de cadeia longa.
Este colágeno é importante na formação de fibrilas de ancoragem, que são como vigas de suporte que proporcionam estabilidade à forma como a camada externa da pele (epiderme) adere à camada mais profunda (derme) em uma interface específica chamada lâmina lúcida/derme papilar [40].
Tipo VIII
O colágeno tipo VIII é produzido por vários tipos de células, incluindo células endoteliais (aquelas que revestem os vasos sanguíneos), queratinócitos (células da camada externa da pele), mastócitos (um tipo de célula imunológica), células endoteliais microvasculares (pequenos vasos sanguíneos) e até algumas células tumorais.
Você pode encontrá-lo em diferentes matrizes extracelulares, como na parte branca do olho (esclera), na pele e nos pequenos filtros dos rins (glomérulo) [6, 41].
No que diz respeito à sua estrutura, o colágeno Tipo VIII é composto por duas cadeias alfa, especificamente, [alfa 1 (VIII) 2 alfa 2 (VIII)] [42].
O seu papel no corpo ainda é desconhecido, embora estudos recentes sugiram que é relativamente importante nos vasos sanguíneos.
Algumas pesquisas indicam que pode desempenhar um papel no movimento das células musculares lisas, o que é fundamental para a manutenção da estrutura dos vasos sanguíneos.
Os pesquisadores especulam que o colágeno tipo VIII pode atuar como uma espécie de base para várias células, ajudando as células endoteliais a se movimentarem durante a formação de novos vasos sanguíneos (angiogênese), ajudando as células musculares lisas a penetrar na camada interna dos vasos sanguíneos (invasão íntima) e auxiliando miofibroblastos durante cicatrizes teciduais (condições fibróticas) [43].
Digite X
O colágeno tipo X é um membro especial da família do colágeno de cadeia curta, encontrado principalmente na cartilagem e crucial para o crescimento e desenvolvimento ósseo.
É encontrado principalmente nas placas de crescimento dos ossos, onde ocorre a formação de novos ossos durante o desenvolvimento e crescimento.
A principal função do colágeno Tipo X é contribuir para o desenvolvimento e mineralização óssea, principalmente nas placas de crescimento.
É como um marcador para um tipo específico de célula cartilaginosa madura chamada “condrócitos hipertróficos”. [44]. Em humanos, até 18% da síntese de colágeno em certas regiões pode ser do Tipo X.
Acredita-se que seu papel auxilia no processo de calcificação, influenciando potencialmente a organização da matriz da cartilagem.
Os pesquisadores acreditam que o colágeno tipo X é vital para a compreensão do crescimento e diferenciação dos condrócitos. Mutações neste tipo de colágeno podem estar ligadas a certos distúrbios do desenvolvimento ósseo [45].
No geral, o colágeno Tipo X fornece uma perspectiva na biologia da cartilagem, ajudando os pesquisadores a aprender mais sobre o crescimento e desenvolvimento ósseo.
Tipo XI
O colágeno tipo XI desempenha um papel na estrutura estrutural do corpo.
Atuando como um colágeno fibrilar, está difundido em vários tecidos, como cartilagem articular, testículos, tendões, ossos, músculos, placenta, pulmões e até mesmo no neoepitélio do cérebro.
Sua função é regular a fibrilogênese, o que ajuda a formar fibrilas de colágeno – aquelas estruturas semelhantes a fios que mantêm nossos tecidos unidos. [46].
Uma de suas funções é manter o espaçamento e o diâmetro das fibrilas de colágeno tipo II, atuando como supervisor para sua adequada formação. Também desempenha um papel no início da formação de colágeno tipos I e II [46].
Pode se ligar a substâncias como heparina, sulfato de heparano e sulfato de dermatano. No entanto, apesar da sua importância potencial, atualmente não dispomos de biomarcadores específicos para medir o colagénio Tipo XI [47].
Tipos XII, XIV e XVI
O colágeno tipo XII é como o supervisor em certas partes do nosso corpo – encontrado principalmente no pericôndrio (uma camada ao redor da cartilagem) e na superfície articular.
É uma molécula “homotrimérica”, o que significa que compreende três partes idênticas. Imagine-o como uma grande estrutura em forma de cruz com domínios específicos que atingem o espaço ao redor das fibrilas de colágeno.
Este colágeno tem duas formas: uma menor encontrada na pele e afins e uma maior descoberta nas células epidérmicas [48].
Agora vamos falar sobre o colágeno tipo XIV. É semelhante, mas com uma estrutura menor em forma de cruz. O colágeno tipo XIV se espalha de maneira mais uniforme em vários tecidos, interagindo com o colágeno tipo I em locais como pele, tendões e muito mais. Não se liga diretamente ao colágeno tipo I, mas sim a uma substância chamada decorina. [48].
Por último, temos o colágeno tipo XVI, sintetizado por fibroblastos e mioblastos. Faz parte do show na matriz territorial dos condrócitos, aquelas células da cartilagem.
Imagine-o como esse player integrado em finas fibrilas de colágeno, convivendo com o colágeno tipo II e XI.
É como uma equipe de bastidores em diferentes partes do nosso corpo, garantindo que as coisas estejam estruturadas corretamente [48].
Você precisa de todos os tipos de colágeno?

Para construir colágeno no corpo, você precisa ter os blocos de construção do colágeno – os aminoácidos incluem glicina, prolina, lisina, hidroxilisina e hidroxiprolina [49].
Além disso, você precisa de vitamina C para ajudar a formar colágeno no corpo. A vitamina C é importante para os tecidos conjuntivos porque permite que uma enzima chamada prolil 4-hidroxilase faça seu trabalho.
Esta enzima é necessária para alterar a prolina, um bloco de construção das proteínas, e ajuda a produzir e liberar pró-colágeno.
Você não precisa ingerir todos os tipos de colágeno, desde que ingerir uma quantidade suficiente dos blocos de construção – ou seja, aminoácidos – dos quais o colágeno é feito.
Suplementos de colágeno, e até mesmo gelatina, são divididos em glicina, prolina, lisina, hidroxilisina e hidroxiprolina e podem ser usados para construir os vários tipos de colágeno no corpo.
A fonte de colágeno é importante?
A proteína de colágeno de origem animal pode não ser adequada para atletas vegetarianos ou veganos.
Embora existam produtos veganos e vegetarianos concebidos para replicar o colagénio de origem animal, se for comprovado que os péptidos exclusivos das proteínas animais possuem actividade biológica distinta, as alternativas vegetarianas e veganas podem ser consideradas menos eficientes.
Mais pesquisas são necessárias para avaliar a disponibilidade de aminoácidos e a eficácia dos substitutos veganos do colágeno.
Várias fontes de colágeno de origem animal apresentam pequenas variações no conteúdo de aminoácidos, mas as diferenças não são significativas o suficiente para declarar um tipo superior a outro.
Tabela 1: Composição de aminoácidos dos 5 principais colágenos e gelatina de mamíferos [50]
| Aminoácido | Gelatina animal | |||||||
| Pele de boi | Osso comercial | Pele de porco | Boi-osso | Pele de tubarão | Pele de peixe-pulmão | Osso | tendão | |
| Glycine | 27.5 | 27.2 | 26.4 | 25.3 | 26.5 | 24 | 25.8 | 25.4 |
| Leucina | 3.3 | 3.5 | 3.3 | 3.9 | 3.5 | 2.8 | 3.6 | 3.6 |
| Prolina | 16.4 | 15.5 | 16.2 | 14.7 | 13.9 | 15.8 | 15.3 | 15.2 |
| hidroxiprolina | 14.1 | 13.3 | 13.5 | 14.1 | 10.9 | 10.8 | 14.1 | 12.6 |
| Hidroxilisina | 1.0 | 0.7 | 1.0 | 1.1 | 0.8 | 1.1 | 0.6 | |
Melhor tipo de colágeno
O debate sobre a superioridade dos tipos de colágeno permanece incerto devido aos seus perfis de aminoácidos semelhantes. O colágeno tipo I surge como uma escolha estratégica devido ao seu papel crucial no reforço de ossos, músculos e tecidos conjuntivos.
O foco deve estar em uma ampla ingestão de aminoácidos para suporte geral de colágeno. Mas, para obter benefícios específicos, optar pelo colágeno tipo I pode ser sua melhor aposta.
Referências
- Abreu-Velez, AM e Howard, MS (2012). Colágeno IV na Pele Normal e em Processos Patológicos. N Am J Med Sci, 4(1), 1-8. doi:10.4103/1947-2714.92892
- Adam, MP, Feldman, J., Mirzaa, GM, Pagon, RA, Wallace, SE, Bean, LJ,. . . Amemiya, A. (1993). GeneReviews®[Internet].
- Alcaide-Ruggiero, L., Molina-Hernández, V., Granados, MM, & Domínguez, JM (2021). Principais e secundários tipos de colágenos na cartilagem articular: o papel dos colágenos na avaliação do tecido de reparo em defeitos condrais. Int J Mol Sci, 22(24). doi:10.3390/ijms222413329
- Aycock, RS e Seyer, JM (1989). Colágenos de fígado humano normal e cirrótico. Pesquisa de tecido conjuntivo, 23(1), 19-31.
- Baar, K. (2017). Minimizando lesões e maximizando o retorno ao jogo: lições dos ligamentos projetados. Medicina Esportiva, 47(Suppl 1), 5-11. doi:10.1007/s40279-017-0719-x
- Bakilan, F., Armagan, O., Ozgen, M., Tascioglu, F., Bolluk, O., & Alatas, O. (2016). Efeitos do tratamento com colágeno tipo II nativo na osteoartrite do joelho: um ensaio clínico randomizado. Eurasiático J Med, 48(2), 95-101. doi:10.5152/eurasianjmed.2015.15030
- Birk, DE (2001). Colágeno tipo V: interações heterotípicas de colágeno tipo I/V na regulação da montagem de fibrilas. Mícron, 32(3), 223-237.
- Byers, PH, Belmont, J., Black, J., De Backer, J., Frank, M., Jeunemaitre, X.,. . . Sanders, L. (2017). Diagnóstico, história natural e manejo na síndrome vascular de Ehlers-Danlos. Artigo apresentado no American Journal of Medical Genetics Parte C: Seminars in Medical Genetics.
- Cao, Q., Mak, KM e Lieber, CS (2002). A DLPC diminui o mRNA do colágeno induzido por TGF-β1 ao inibir a p38 MAPK em células estreladas hepáticas. American Journal of Physiology-Gastrointestinal and Liver Physiology, 283(5), G1051-G1061.
- Chung, HJ e Uitto, J. (2010). Colágeno tipo VII: a proteína fibrila de ancoragem responsável pela epidermólise bolhosa distrófica. Clínica Dermatol, 28(1), 93-105. doi:10.1016/j.det.2009.10.011
- Clifford, T., Ventress, M., Allerton, DM, Stansfield, S., Tang, JCY, Fraser, WD,. . . Stevenson, E. (2019). Os efeitos dos peptídeos de colágeno no dano muscular, inflamação e renovação óssea após o exercício: um ensaio randomizado e controlado. Aminoácidos, 51(4), 691-704. doi:10.1007/s00726-019-02706-5
- Di Martino, A., Cescon, M., D'Agostino, C., Schilardi, F., Sabatelli, P., Merlini, L., & Faldini, C. (2023). Colágeno VI no Sistema Musculoesquelético. Int J Mol Sci, 24(6). doi:10.3390/ijms24065095
- Dong, C. e Lv, Y. (2016). Aplicação de andaime de colágeno na engenharia de tecidos: avanços recentes e novas perspectivas. Polímeros (Basileia), 8(2). doi:10.3390/polym8020042
- Ellingson, AJ, Pancheri, NM e Schiele, NR (2022). Reguladores da reticulação do colágeno em tendões em desenvolvimento e adultos. Eur Cell Mater, 43, 130-152. doi:10.22203/eCM.v043a11
- Frantz, C., Stewart, KM e Weaver, VM (2010). A matriz extracelular em resumo. J Cell Sci, 123(Pt 24), 4195-4200. doi:10.1242/jcs.023820
- Hasegawa, H., Naito, I., Nakano, K., Momota, R., Nishida, K., Taguchi, T., . . . Ohtsuka, A. (2007). As distribuições das cadeias α do colágeno tipo IV nas membranas basais da epiderme humana e anexos da pele. Arquivos de histologia e citologia, 70(4), 255-265.
- Holwerda, AM e van Loon, LJC (2022). O impacto da ingestão de proteínas de colágeno na remodelação do tecido conjuntivo musculoesquelético: uma revisão narrativa. Nutr Rev, 80(6), 1497-1514. doi:10.1093/nutrit/nuab083
- Horn, D., Siebert, E., Seidel, U., Rost, I., Mayer, K., Abou Jamra, R.,. . . Kornak, U. (2017). Mutações bialélicas do COL3A1 resultam em um espectro clínico de anomalias cerebrais estruturais específicas e anormalidades do tecido conjuntivo. Jornal americano de genética médica Parte A, 173(9), 2534-2538.
- Jørgensen, A., Fagerheim, T., Rand-Hendriksen, S., Lunde, PI, Vorren, TO, Pepin, MG,. . . Byers, PH (2015). Síndrome vascular de Ehlers-Danlos em irmãos com variantes bialélicas da sequência COL3A1 e marcada variabilidade clínica na família extensa. Jornal Europeu de Genética Humana, 23(6), 796-802.
- Kannus, P. (2000). Estrutura do tecido conjuntivo do tendão. Scand J Med Sci Sports, 10(6), 312-320. doi:10.1034/j.1600-0838.2000.010006312.x
- Kapandji, I. (1977). A fisiologia das articulações. Churchill Livingstone, 2, 186-189.
- Khoshnoodi, J., Pedchenko, V. e Hudson, BG (2008). Colágeno de mamífero IV. Tecnologia de resolução Microsc, 71(5), 357-370. doi:10.1002/jemt.20564
- Konomi, H., Hayashi, T., Nakayasu, K., & Arima, M. (1984). Localização de colágeno tipo V e colágeno tipo IV na córnea, pulmão e pele humanos. Evidência imunohistoquímica por anticorpos anticolágeno caracterizados por imunoeletroblotting. O jornal americano de patologia, 116(3), 417.
- Kuivaniemi, H. e Tromp, G. (2019). Colágeno tipo III (COL3A1): Estrutura genética e proteica, distribuição tecidual e doenças associadas. Gene, 707, 151-171. doi:10.1016/j.gene.2019.05.003
- Lian, C., Wang, X., Qiu, X., Wu, Z., Gao, B., Liu, L.,. . . Peng, Y. (2019). O colágeno tipo II suprime a hipertrofia articular dos condrócitos e a progressão da osteoartrite, promovendo a interação da integrina β1-SMAD1. Pesquisa óssea, 7(1), 8.
- Luo, YY e Karsdal, MA (2016). Capítulo 11 – Colágeno Tipo XI. Em MA Karsdal (Ed.), Bioquímica de Colágenos, Lamininas e Elastina (pp. 77-80): Imprensa Acadêmica.
- Mak, KM, Png, CY e Lee, DJ (2016). Colágeno Tipo V na Saúde, Doença e Fibrose. Anat Rec (Hoboken), 299(5), 613-629. doi:10.1002/ar.23330
- Malfait, F., Francomano, C., Byers, P., Belmont, J., Berglund, B., Black, J.,. . . Burrows, NP (2017). A classificação internacional de 2017 das síndromes de Ehlers-Danlos. Artigo apresentado no American Journal of Medical Genetics Parte C: Seminars in Medical Genetics.
- Miller, EJ, Epstein Jr, EH e Piez, KA (1971). Identificação de três colágenos geneticamente distintos pela clivagem com brometo de cianogênio do colágeno insolúvel da pele humana e da cartilagem. Comunicações de Pesquisa Bioquímica e Biofísica, 42(6), 1024-1029.
- Moriya, K., Bae, E., Honda, K., Sakai, K., Sakaguchi, T., Tsujimoto, I.,. . . Sakai, T. (2011). Um mecanismo independente de fibronectina de fibrilogênese de colágeno na remodelação do fígado adulto. Gastroenterologia, 140(5), 1653-1663.
- Muragaki, Y., Jacenko, O., Apte, S., Mattei, M., Ninomiya, Y., & Olsen, BR (1991). O gene do colágeno alfa 2 (VIII). Novo membro da família do colágeno de cadeia curta localizado no cromossomo 1 humano. Jornal de Química Biológica, 266(12), 7721-7727.
- Myllyharju, J. e Kivirikko, KI (2004). Colágenos, enzimas modificadoras e suas mutações em humanos, moscas e vermes. TENDÊNCIAS em Genética, 20(1), 33-43.
- Nah, HD, Swoboda, B., Birk, DE e Kirsch, T. (2001). Procolágeno tipo IIA: expressão no desenvolvimento de cartilagem de membro de galinha e cartilagem articular osteoartrítica humana. Dinâmica do Desenvolvimento: Uma Publicação Oficial da Associação Americana de Anatomistas, 220(4), 307-322.
- Naomi, R., Ridzuan, PM e Bahari, H. (2021). Insights atuais sobre o colágeno tipo I. Polímeros (Basileia), 13(16). doi:10.3390/polym13162642
- Olsen, BR (1995). Novos insights sobre a função dos colágenos a partir da análise genética. Opinião atual em biologia celular, 7(5), 720-727.
- Patel, K., Munir, D. e Santos, R. (2022). Uso benéfico de peles de animais para gestão de resíduos de matadouros e curtumes: uma revisão de abordagens não convencionais, inovadoras e sustentáveis. Ciência Ambiental e Pesquisa sobre Poluição, 29. doi:10.1007/s11356-021-17101-5
- Plancke, A., Holder-Espinasse, M., Rigau, V., Manouvrier, S., Claustres, M., & Van Kien, PK (2009). A homozigosidade para um alelo nulo de COL3A1 resulta na síndrome de Ehlers-Danlos recessiva. Jornal Europeu de Genética Humana, 17(11), 1411-1416.
- Plenz, GA, Deng, MC, Robenek, H. e Völker, W. (2003). Colágenos vasculares: destaque para o papel do colágeno tipo VIII na aterogênese. Aterosclerose, 166(1), 1-11.
- Ricard-Blum, S. (2011). A família do colágeno. Cold Spring Harb Perspect Biol, 3(1), a004978. doi:10.1101/cshperspect.a004978
- Schmid, TM e Linsenmayer, TF (1990). Microscopia imunoeletrônica do colágeno tipo X: formas supramoleculares na cartilagem embrionária de pintinho. Dev Biol, 138(1), 53-62. doi:10.1016/0012-1606(90)90176-j
- Shen, G. (2005). O papel do colágeno tipo X na facilitação e regulação da ossificação endocondral da cartilagem articular. Orthod Craniofac Res, 8(1), 11-17. doi:10.1111/j.1601-6343.2004.00308.x
- Shuttleworth, CA (1997). Colágeno tipo VIII. Int J Biochem Cell Biol, 29(10), 1145-1148. doi:10.1016/s1357-2725(97)00033-2
- Smith, SM e Melrose, J. (2019). As interações colágeno-perlecano-HS tipo XI estabilizam a matriz pericelular das células do anel fibroso e dos condrócitos, proporcionando estabilização da matriz e homeostase. Jornal de Histologia Molecular, 50(3), 285-294. doi:10.1007/s10735-019-09823-1
- Söderhäll, C., Marenholz, I., Kerscher, T., Rüschendorf, F., Esparza-Gordillo, J., Worm, M., . . . Rohde, K. (2007). Variantes de um novo gene do colágeno epidérmico (COL29A1) estão associadas à dermatite atópica. Biologia PLoS, 5(9), e242.
- Sorushanova, A., Delgado, LM, Wu, Z., Shologu, N., Kshirsagar, A., Raghunath, R.,. . . Zeugolis, DI (2019). A Suprafamília do Colágeno: Da Biossíntese ao Desenvolvimento Avançado de Biomateriais. Adv Mater, 31(1), e1801651. doi:10.1002/adma.201801651
- Uzawa, K., Kasamatsu, A. e Yamauchi, M. (2023). Reticulação de colágeno no câncer bucal. Ciência Oral Internacional, 21. doi:10.1002/osi2.1182
- van der Rest, M. e Garrone, R. (1991). Família de proteínas do colágeno. Faseb j, 5(13), 2814-2823.
- Von Der Mark, K. (2006). CAPÍTULO 1 – Estrutura, Biossíntese e Regulação Gênica de Colágenos na Cartilagem e Osso. Em MJ Seibel, SP Robins e JP Bilezikian (Eds.), Dinâmica do metabolismo ósseo e cartilaginoso (segunda edição) (págs. 3-40). Burlington: Imprensa Acadêmica.
- Wolff, K., Goldsmith, LA, Katz, SI, Gilchrest, BA, Paller, AS, & Leffell, DJ (2008). Dermatologia de Fitzpatrick em medicina geral: McGraw-Hill Nova York.
- YANG, CL, RUI, H., MOSLER, S., NOTBOHM, H., SAWARYN, A., & MÜLLER, PK (1993). Colágeno II da cartilagem articular e do anel fibroso: Implicação estrutural e funcional de modificações pós-traducionais específicas do tecido das moléculas de colágeno. Jornal Europeu de Bioquímica, 213(3), 1297-1302.
